2022.10.23改訂(2009.9.23)
pirika.comで化学 > 化学全般
> 次世代HSP2, YMB Pro for MI >
> 解析例トップ
医薬品・化粧品トップページ > ハンセン溶解度パラメータ(HSP)と医薬品の残留溶媒
概要
医薬品を合成するようの溶媒は注意が必要だ。
それは溶媒が医薬品に取り込まれたまま人体に直接投入されかねないからだ。
それでは、安全性が確認されている溶媒群(Class3)の、組み合わせと混合比率を変えて、その医薬品を溶解する混合溶媒を設計できないだろうか?
我々の提案はHSPを使うことだ。
混合溶媒のペアを選び出し、その混合比率を答えてくれるソフトウエアーはHSPiPだけだろう。
同じことではあるが、NMR測定用の重溶媒を組み合わせ、混合比率まで求めたい時にもHSPは有効だ。
内容
元は、化学工業社、化学工業2010年5月号に投稿したものだ。(化学工業社はなくなってしまったのでpdfを載せておく)
Abstruct:
医薬品を合成する際には、多くの場合、溶媒を用いる。
この溶媒が医薬品に残存した場合には、医薬品とともに直接人体に投入されることになるため,ICH(International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use)によって「医薬品の残留溶媒ガイドライン」が定められている。
これは溶媒を3つのクラスに分け,毒性の高いもの,環境に悪影響を与えるものをなるべく使わずに医薬品を作ろうというガイドラインである。
しかし,医薬品の分子構造によっては,人体に低毒性とされるクラス3の溶媒には溶解しないものが存在する。
そのような場合にはクラス2の溶媒を使い,医薬品中の残存量を厳しく管理することになる。
また,近年の地球温暖化問題,オゾン層破壊問題からも,合成に利用できる溶媒はますます狭まってきている。
そのような状況の中,ある化合物が溶媒(混合溶媒)にどの程度溶解するかを予測する技術は非常に重要になってきている。
ハンセンの溶解度パラメーター (HSP: Hansen Solubility Parameter)はCharles M. Hansenによって40年以上前(1967年)に開発され,現在も改良が続けられている技術である。
これは,ある溶質があった時に,どのような溶媒(混合溶媒)がその溶質を溶解するかを判定するのに非常に優れた方法として知られている。
本稿では,HSPの簡単な説明と,HSPを使った溶媒探索法について解説する。
緒言
有機合成では,さまざまな溶媒が用いられているが,その溶媒を医薬品に使おうとした場合には注意が必要である。
医薬品の中に残留する溶媒は人体に直接,投入されかねないからである。
この残留溶媒に関しては「医薬品の残留溶媒ガイドライン」が,ICHによって作成されている。
このガイドラインは,溶媒をその毒性によって3つのクラスに分ける。
クラス1の溶媒:
医薬品を製造する際には使うべきでない溶媒。
人間に対する発がん性,環境に対して有害な影響を与える溶媒がクラス1に相当する。
ベンゼン,4塩化炭素,1,2−ジクロロエタン,1,1ージクロロエチレン,1,1,1−トリクロロエタンがこの分類に属する。
クラス2の溶媒:
医薬品中の残留を規制すべき溶媒:
動物実験で発がん性を示すか,神経毒性,催奇形性などがある溶媒。
アセトニトリル,クロロベンゼン,クロロホルム,エチレングリコール,ヘキサン,メタノール,DMF,ピリジン,トルエンなどがこの分類に属する。
クラス3の溶媒:
人に対しては低毒性とされる溶媒。
アセトン,酢酸エチル,イソプロパノールなどがこのクラスに属するが,有害大気汚染物質(HAP)などで別に規制される。
(また、安全性が確認されていないが汎用である溶媒群を、便宜的にクラス4として分類した。)
クラス1,2の溶媒は,医薬品を作る上での濃縮,蒸発除去不足などを考えた場合には使わないにこした事は無い。
しかし,”溶媒を使う事の意味合い”を考えた場合,全く無しでは済まされない事が多い。
それでは,何故,溶媒を使うか?であるが,溶媒である以上,何か対象となるものを溶かすのが最大の目的である。
溶かせば,
收率や選択性が上がる,
再現性があがる,
加熱(冷却)しやすい,
分離(再結晶,抽出「HSPを使った抽出の記事はこちら」)しやすい
などを期待して溶媒を利用する。
従って,人体や環境に悪影響を与えない溶媒であっても,目的とする化合物を溶かさないのでは代替溶媒としては不適切である。
それでは,どうしたら対象とする化合物を溶解する溶媒を,クラス3の溶媒群にあるものだけを使って探索できるだろうか?
これを,HSPを使って探索する方法を紹介する。
HSPの基礎
ポリマーの研究者にとっては溶解度パラメータはなじみのある概念であるが、有機合成の分野では余り知られていないだろう。
おおもとの研究はHildebrandによってなされた。
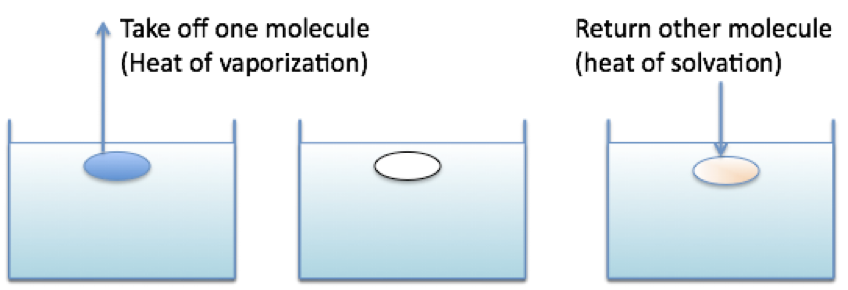
溶解度パラメーターの基本概念
溶媒に溶質を溶解する混合の自由エネルギーは
ΔG=ΔH-ΔTS 式(1)
であらわされ,これがゼロかマイナスの時に混合がおこる。
その時のΔHを
ΔH=φ1φ2V(σ1-σ2)^2 式(2)
φ:volume ratio,σ:SP value
とした時に,初めて溶解度パラメーター(SP値)の概念が生まれた。
SP値が近いもの同士はΔHが小さく,ΔGがゼロかマイナスになりやすい。
そこで,”似たものは似たものを溶かす”という原理が生まれた。
σ={(ΔH-RT)/V}0.5 式(3)
ΔH:蒸発潜熱、R:ガス定数、V:分子体積
一般的には蒸発潜熱から、式(3)を使ってSP値が求められ,様々なデータベース,ハンドブックにその値が記載されている。
Hansenはこの蒸発のエネルギーを分散項(dD),分極項(dP),水素結合項(dH)に分解し3次元ベクトルとしてとらえる考え方を確立した。
そして,このベクトルの距離が短いもの同士は良く溶解するというのがHansenらの考え方である。つまり”ベクトルの似たものは,ベクトルの似たものを溶かす”というのが大原則になる。
その距離の計算方法は通常のベクトルの長さの計算方法と少し異なり,
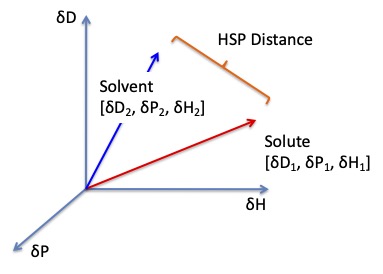
HSP distance(Ra)={4*(dD1-dD2)2 + (dP1-dP2)2 +(dH1-dH2)2 }0.5 式(4)
と,dDの前に4という係数がつく。
様々な溶媒,ポリマーなどのHSPがHansenの著書に記載されている。
またAbbott教授,Hansen先生と私(山本博志)によって作られたソフトウエアー,HSPiP (Hansen Solubility Parameter in Practice)を用いれば,溶媒の最新のHSPと,データベースに無い化合物については分子構造のみから推算する事ができる。
このHSPの考え方を用いて,実際の化合物の溶解性を検討する。
溶解度の検討結果
Abietic acidの溶解度
最初の例としては Abietic acid (CAS# 514-10-3)を取り上げる。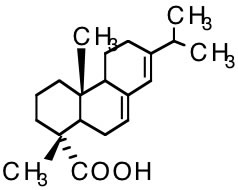
Abietic acidは“松やに”の主成分として知られ,ハンダ付けをした後に,そのフラックスを洗浄除去するのにCFC-113が使われた。
そのCFC-113の代替洗浄溶媒の探索過程で様々な溶媒に対するAbietic acidの溶解度が検討された。
Abietic acidの化学構造を見ただけで,どのような溶媒がこの化合物を溶かすかを予測する事は非常に困難である。
例えば13種類の溶媒に対する溶解度を示す。
| CAS | Name | HCode | SMILES | Solubility (g/100ml) |
|---|---|---|---|---|
| 67-56-1 | methyl alcohol Methanol | 456 | OC([H])([H])[H] | |
| 64-17-5 | ethyl alcohol Ethanol | 325 | CCO | |
| 67-64-1 | acetone | 7 | CC(C)=O | 23.1 |
| 78-93-3 | methyl ethyl ketone (MEK) 2-butanone | 481 | CC(CC)=O | 35 |
| 60-29-7 | diethyl ether | 255 | CCOCC | 81 |
| 108-88-3 | toluene | 637 | CC1=CC=CC=C1 | 91 |
| _75-09-2 | dichloromethane methylene chloride | 524 | [H]C(Cl)(Cl)[H] | 94 |
| 67-66-3 | chloroform | 156 | ClC(Cl)(Cl)[H] | 116 |
| 71-55-6 | 1,1,1-trichloroethane | 647 | CC(Cl)(Cl)Cl | 71 |
| 79-00-5 | 1,1,2-trichloroethane | 648 | ClC(Cl)CCl | 45 |
| 107-06-2 | 1,2-dichloroethane | 367 | C(CCl)Cl | 35 |
| _79-01-6 | trichloroethylene | 649 | [H]/C(Cl)=C(Cl)Cl | 122 |
| 127-18-4 | tetrachloroethylene | 615 | Cl/C(Cl)=C(Cl)/Cl | 71 |
| 76-13-1 | 1,1,2-trichloro-1,2,2-trifluoroethane CFC-113 | 652 | FC(F)(Cl)C(Cl)(Cl)F | 0.8 |
| 507-55-1 | HCFC 225cb | 505 | ClC(F)(F)C(F)(F)C(F)([H])Cl | 0.7 |
| 1717-00-6 | 1,1-dichloro-1-fluoroethane HCFC-141b | 240 | ClC(Cl)(F)C([H])([H])[H] | 1.1 |
| 56-23-5 | carbon tetrachloride | 122 | ClC(Cl)(Cl)Cl | 3.2 |
CFC−113やHCFC-225では0.7-0.8g/100g Solventと適度に溶解し,例えば半田づけに使った”松やに”は溶解するが,電子基板上の他のプラスティックは溶解しないという特性があった。
何故ある溶媒は Abietic acidを溶解して,他の溶媒は溶解しにくいのか?をHSPを使って検討する。
HSPの基本は,似たベクトルは似たベクトルを溶かすであった。
各溶媒のHSPを最新のHSPiPを用いて準備する。
溶媒のHSPはハンドブック3)やインターネットにも記載がある。
Abietic acidのHSPは入手が困難なので,HSPiPを利用しなくてはならない。アビエチン酸のSmilesの式はC[C@](C(CCC(C(C)C)=C3)C3=CC1)(CCC2)C1[C@@]2(C)C(O)=O
になる。これをHSPiPのY-MBに入力して計算ボタンを押すと,自動的に分子を原子団に分解して,HSPを計算してくれる。
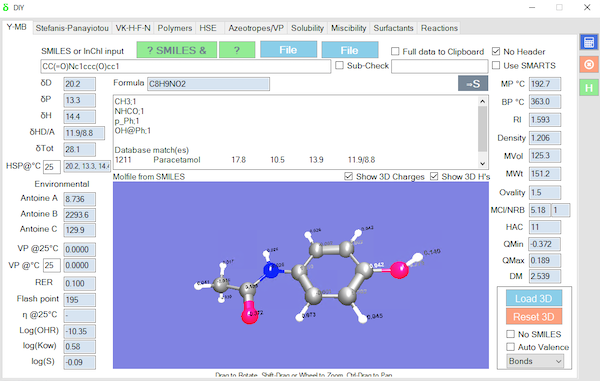
結果は,[20.3, 2.8, 6.3]で分子体積は302.5になった。(ver. 2.0 の結果:最新のHSPiPを用いて自分でやってみよう)
この値とHSPの距離を計算する式(1)を使ってアビエチン酸と溶媒のHSP距離(Ra)を計算する。
この距離が短ければ,似たベクトルは似たベクトルを溶かすという原理によって溶解度が大きいはずである。
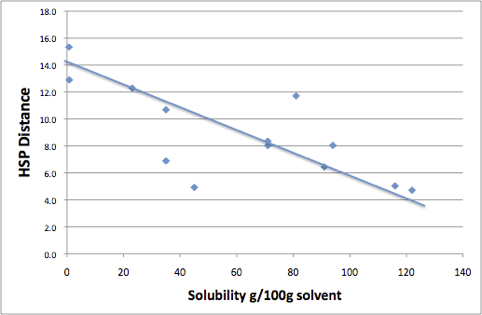
結果を見ると,例外が3化合物ほどあるが,基本的にはHSP距離が8以下の溶媒には良く溶け,10以上の溶媒には余り溶けないというルールが成立する事がわかる。
つまり,ここで検討した以外の溶媒で,良溶媒を探索したいのから,HSP距離が8以下のものを,貧溶媒を探索したいのなら,10以上のものを探索すれば確率が高い事がわかる。
Oleic Acidの溶解度
Oleic Acid (CAS# 112-80-1)は,FAME(Fatty Acid Methyl Esters)溶媒の観点から,その溶解度が様々に検討されている。
2025.5
次世代HSP2を使った「あなたは、酸? 塩基?」でオレイン酸の溶解性を解説した。
Oleic AcidのHSPはオフィシャル・データベース(#545)にあり,その値は[16.0, 2.8, 6.2]であった。
| CAS | Name | HCode | SMILES | Solubility(g/100ml at-10℃) |
|---|---|---|---|---|
| _75-05-8 | acetonitrile | 10 | [H]C@@([H])C#N | 1.1 |
| 67-64-1 | acetone | 7 | CC(C)=O | 27.4 |
| 67-63-0 | isopropyl alcohol IPA 2-propanol | 570 | OC(C)C | 55 |
| 141-78-6 | ethyl acetate | 328 | CC(OCC)=O | 44 |
| 123-86-4 | butyl acetate | 102 | CC(OCCCC)=O | 48 |
| 123-91-1 | 1,4-dioxane | 306 | C1COCCO1 | |
| 60-29-7 | diethyl ether | 255 | CCOCC | 60 |
| 107-06-2 | 1,2-dichloroethane | 367 | C(CCl)Cl | 26.1 |
| 79-24-3 | nitroethane | 532 | CCN+=O | 2.2 |
| 75-52-5 | nitromethane | 534 | [H]C@(N+=O)[H] | 0.6 |
| 98-95-3 | nitrobenzene | 531 | O=N+C1=CC=CC=C1 | |
| _98-01-1 | furfural | 404 | [H]C(C1=CC=CO1)=O | 1.3 |
| 71-36-3 | butanol 1-Butanol, Butyl Alcohol | 92 | CCCCO | 56.5 |
| 78-93-3 | methyl ethyl ketone (MEK) 2-butanone | 481 | CC(CC)=O | 33.5 |
| 110-54-3 | hexane | 417 | CCCCCC | 44.4 |
| 71-43-2 | benzene | 52 | C1=CC=CC=C1 | |
| 67-56-1 | methyl alcohol Methanol | 456 | OC([H])([H])[H] | 31.6 |
| 95-47-6 | o-xylene | 698 | CC1=C(C)C=CC=C1 | 88 |
| 108-90-7 | chlorobenzene | 148 | ClC1=CC=CC=C1 | 85 |
| 67-66-3 | chloroform | 156 | ClC(Cl)(Cl)[H] | 92 |
| 56-23-5 | carbon tetrachloride | 122 | ClC(Cl)(Cl)Cl | 68 |
| 110-82-7 | cyclohexane | 181 | C1CCCCC1 | 80 |
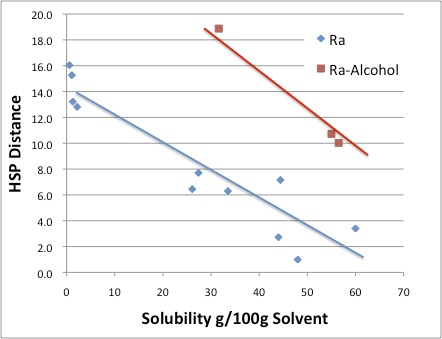
この場合は非常に興味深いことに,上図に示すようにアルコール類のOleic Acidの溶解度は特異的におかしな値になる。
それ以外の溶媒に関しては,ベクトルの似ている溶媒は,ベクトルの似ているものを溶解するという原理で考えて問題ない事がわかる。
何故,アルコールだけ大きくずれるのか?
アルコール類は大きなdH(水素結合項)を持つ。
通常のHSPの考え方は,このdHまで含めたHSP距離で評価する。
ところがある種の溶質の溶解性を考えた時には,このdHが効かなくなる事がある。
アルコールの水酸基が水素結合によりクラスターを作り,アルキル基を外側に向けたような構造を作り,水酸基が溶解に関与しない構造になっているのではないかと考えられている。
そのような場合にはHSP距離ではなく,dP(分極項)のみに対して溶解度をプロットするとアルコールも含めて溶解性をうまく説明できる,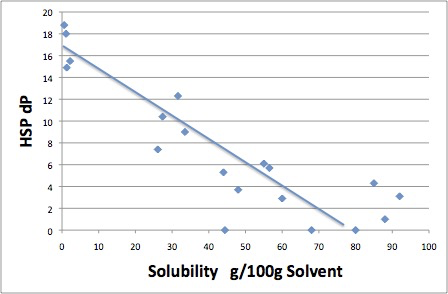
このようにアルコールに対して独特の溶解性を示す化合物は,分子中にカルボキシル基を持つ事が多い。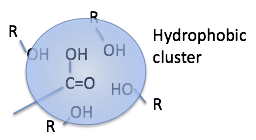
医薬品,その原料には分子中にカルボキシル基を持つ事も多いので,その際には注意が必要である。
また,Abietic acidの3点の異常値も分子中のカルボン酸の影響の可能性が高い。
さらに溶解度は溶媒分子の大きさにも密接に関連がある。
大きいもの、枝分かれのある物は浸透しにくいため同じHSPベクトルであっても溶解度は低くなる。
混合溶媒の考え方
医薬品の合成溶媒に対して,HSPを利用する事を考えるならば,クラス1,2の溶媒を,クラス3の溶媒,もしくは混合溶媒で同等の溶解性を示す溶媒を提案できるかどうかが問題になる。
HSPでは混合溶媒の溶解度パラメーターはベクトルの足し算で表現する( Fig.10 )。溶媒1と溶媒2を体積比でa : b で混合すると、その混合HSPは
[dDm, dPm, dHm]=[(a*dD1+b*dD2), (a*dP1+b*dP2), (a*dH1+b*dH2)]/(a+b)
で表す事ができる。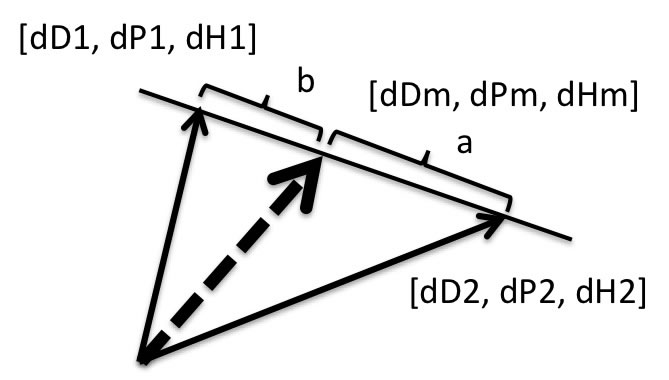
この混合ベクトルの溶質からの距離(Ra)が小さければ、その溶質を溶かす可能性が高い。
また、溶媒一つ一つは貧溶媒(ベクトルが似ていない)であっても、混合溶媒のベクトルが溶質のベクトルに近ければその溶質を溶解することがあり、事実、ポリマーの混合溶媒では、貧溶媒の組み合わせが良溶媒になる例が多数見つかっている。
このような探索は手作業でもできなくは無いが、HSPiPを利用すれば非常に簡単に探索することができる。
2011.4.22
Oleic Acid のDouble Shpher表示
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
溶媒をクリックすれば溶媒の名前が現れる。
アボット教授が,Q3Cのクラス3.4の溶媒で,クラス1,2溶媒と同等のHSPをもつ混合溶媒の種類と比率を決定できるようにHSPiPに2つのファイルを付け加えた。
一つはQ3C(R) 3 and 4.sofだ。sof (Solvent Optimization File)は最適化するのに使う溶媒群を登録しておくのに使う。(最新版では、xmlフォーマットのsofxになっている。)
ここには,クラス3と4の溶媒が登録してある。
クラス4については,毒性が明らかではないものと記述されているので,必要と考えるならば,クラス4のものは置き換えられる側の溶媒に移す必要がある。
もう一つのファイルはQ3C(R) 1 and 2.ssdだ。ssd(Sphere Solvent Data)には置き換えたい溶媒を登録しておく。(ssdフォーマットは、hsd: Hansen Sphere Data, さらにhsdxフォーマットに変更になっている)
そのファイルをHSPiPというソフトウエアーを用いてオープンすると以下のような画面が出てくる。第2版の古い画像であるが、最新のHSPiPにもQ3C(R) 1 and 2.hsdxが入っているので同じようにやってみよう。
そして,代替溶媒を探したい溶媒として,例えば1,2-Dichloroethane を選択して,右のボタンから”O”,open the Solvent Optimizer ボタンを選択する。
すると最適化に使う溶媒群が登録されている,OptimizerSolvents.sofがオフセットでは開く。
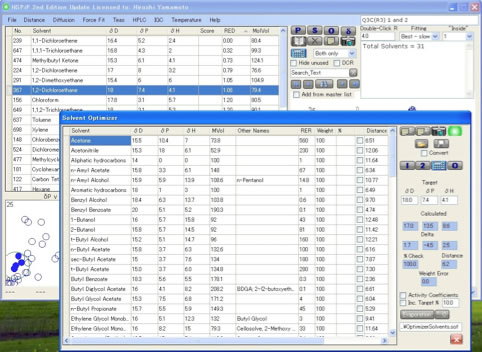
先程の1,2-DichloroethaneのHSPの値がターゲットの所にコピーされている。
“Open an Optimizer Solvent Set”ボタンを押すことによって、どんな溶媒群を使って探索をするかを決めることができる。
ここではQ3C(R3) 3 and 4.sofを選ぶ。
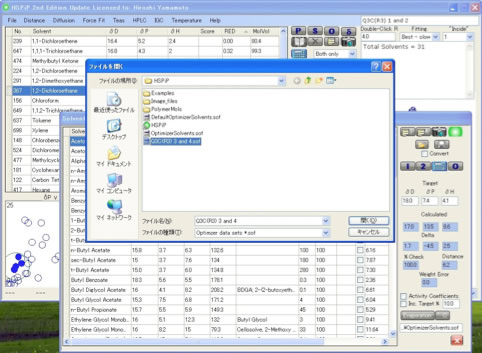
その後は単に “2: Find the Best 2 Solvents”を押せば、Cumene:DMSO=62:38が提案される。
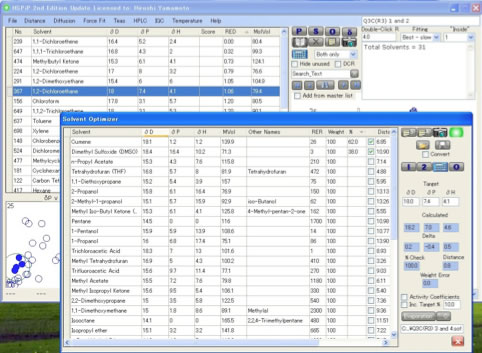
この場合、Cumene-1,2-Dichloroethane のHSP距離は6.85,DMSO-1,2-DichloroethaneのHSP距離は10.90である。
どちらの溶媒も1,2-Dichloroethaneからは遠くはなれているが、Cumene:DMSO=62:38 の混合溶媒のHSPは[18.2, 7.0, 4.6] になり1,2-Dichloroethane [18.0, 7.4, 4.1] との距離は0.8になる。
これと同じ考え方で、NMR用の混合溶媒が設計できる。
NMRを測定用の重溶媒は種類に限りがあり、それに溶解しないと測定することは非常に困難だ。
この重溶媒がsofファイルとしてHSPiPに搭載されているので、目的の化合物のHSPがあれば、混合溶媒を設計することができる。
このような混合溶媒が探索される溶解理論はHSPだけである。
ただし,ここで注意していただきたいのだが,ある反応の溶媒を置き換えたいと考える時に,わざわざクラス1,2の溶媒の代替を探索する必要は無い。
溶解したい化合物のHSPを計算し,そのHSPと近い混合溶媒をクラス3の溶媒群から直接探索する方が効率的である。
例えばAbietic acidを溶解したいのであれば,Abietic acidのHSP[20.3, 2.8, 6.3]に近い混合溶媒をクラス3の溶媒群から直接探索すれば良い。
実際に探索してみた所,トリクロロ酢酸を使った系を提案した。
その溶媒を使いたくない場合,Ctl-クリックする事によってその溶媒を探索から除外できる。(灰色でマークされる)
そして再び探索した所,アニソールとクメン=73:27の混合溶媒が探索された。
トルエンやエーテル化合物が良溶媒なのでこの混合溶媒も良溶媒であると推測される。
目的の化合物のHSPがなければ、中性の分子であれば、その多くはY-MBという物性推算機能を用いて予測値を得ることができる。
HSPiPには更に定量的な溶解性を計算するSphere Data機能も搭載されているので試して頂きたい。
我々の方法はやみくもにトライ・アンド・エラーで探索を行うより合理的に,素早く代替溶媒を探索できると確信している。
医薬品の種類によっては、HSPiPで定義されている167種類の官能基の足し合わせでは表現できない事も多々ある。 (最新版では172種類に拡張されている。)
その場合には官能基の種類を拡張しなければならない。
代表的なHSPを持つ16種類の溶媒に対する溶解度を測定結果があれば新しい官能基のパラメータが決定できる。
またHPLCのリテンション・タイム(HSPとHPLCの関係はこちらの記事参照)から、おおよその見当をつけることができる。
クラス1、2の溶媒のガスクロ分析の結果が、アジレントのアプリケーションノートにあった。これをHSPを用いて解析した結果はこちら。
有機合成にマイクロ波を使う場合、どんな分子の時、反応が加速されるのだろうか?
(2dP+dH)volumedDの値が大きい分子だ。
合成が終わった後、生成物を液液抽出で分離したい。などと言う場合はこちらの記事を参照。
HSPiPの使い方その3:反応の副生成物を抽出除去する溶媒を探索する。
使い方が分かりづらいというユーザーにハンズ・オンで説明した。その説明の改訂版。
pirika.comで化学 > 化学全般
> 次世代HSP2, YMB Pro for MI >
> 解析例トップ
医薬品・化粧品トップページ > ハンセン溶解度パラメータ(HSP)と医薬品の残留溶媒
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください
