2020.12.27
PirikaでSTEAM>デジタル分子模型で見る化学結合> 7. HOMO-LUMO遷移エネルギーと化学結合。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
第5章で、2重結合は回転できないと書きました。
2重結合が回転できないとすると、2重結合の両端に2個置換基のついた構造は2種類あります。
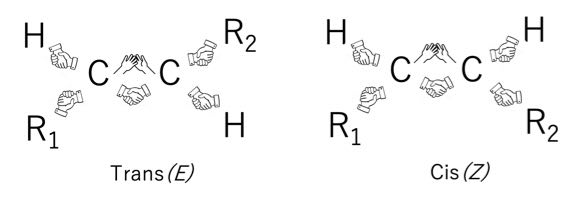
現実としても、このシス体、トランス体は沸点も異なり分離が可能です。
この異性体を幾何異性体と呼びます。
しかし、2重結合が回転できないというのは実は間違いです。
多くの光異性化反応が検討されています。
分子軌道を作るときに、電子はエネルギーの低い分子軌道から2個ずつ入っていくと説明しました。
そして、分子が持っている電子が全部入り終わると、それよりずっと高いエネルギーの所に電子の入っていない空軌道が現れます。
光を当てると、電子が入った一番エネルギーの高い分子軌道(HOMO)から、電子の入っていない一番エネルギーの低い分子軌道(LUMO)に電子が励起されます。
例えば、trans-2-ブテンをCNDO/2で計算してみると、LUMOは下図のようになります。
見やすいように分子を回転してみてください。
今までは、このLUMOには電子が入っていなかったのですが、光のエネルギーを与えると、HOMOの電子が励起され、LUMOに入ります。
しかし、LUMOの分子軌道は、π結合の位相が反転している状態です(節があるという言い方をします)。
HOMOのπ結合は握手しているσ結合ほどでは無いにしても、ハイタッチして安定化していました。ところが、LUMOのπ結合は、重なりが起こらない位相の違うπ結合なので、ゲンコツでぶつかり合っているようなもので安定化できません。
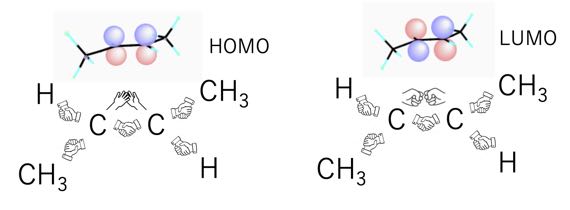
つまり、通常では、σ結合とπ結合の2本の化学結合があるので、そこは回転できませんでしたが、光励起すると、π結合は反結合性になるので、炭素-炭素結合は回転した方が安定になります。
それでは、どこまで回転するのでしょうか?
それを考える前に、cis-2-ブテンをCNDO/2で計算してみましょう。
trans-2-ブテンと同じで、LUMOは反結合性軌道になります。
つまり、trans体でも、シス体でも光励起されたLUMOはπ結合は反結合性になって、炭素-炭素結合は回転したがっているのです。
次に示しているのは、trans-2-ブテンの分子です。
平面分子なので2面角は180°になります。
光励起したときには、π結合が反結合性なので2重結合の部分で回転してエネルギーを下げようとします。
第1章で説明した、Shift-ドラッグをすると2重結合の間で回転をします。
どんどん回して行くと2面角が0°になります。
しかし、2面角が0°の化合物は、そもそもcis-2-ブテンで、これも光励起するとπ結合が反結合性なので2重結合の部分で回転してエネルギーを下げようとします。
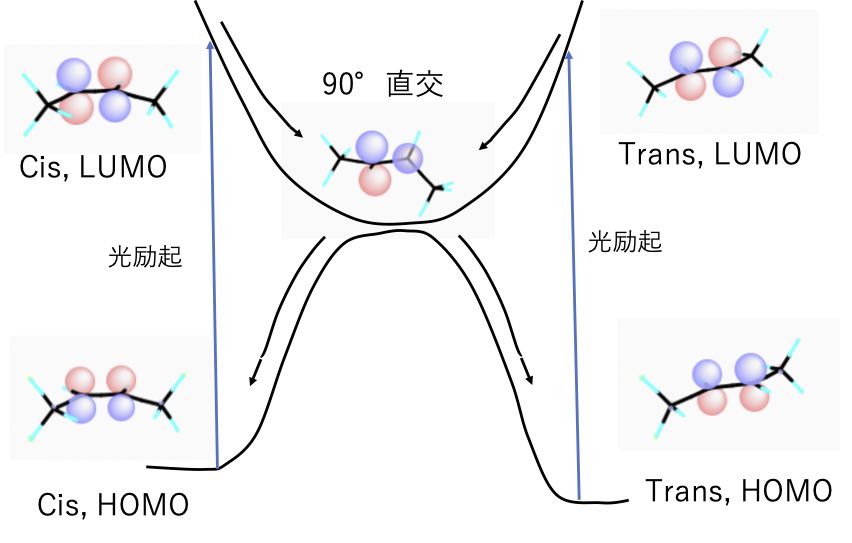
どちらから回しても、反結合性のエネルギーを一番緩和するには90°回転させた時だとわかります。
つまり、どちらの化合物も光エネルギーを吸収するとLUMOに励起され、どちらの化合物も2重結合を90°回転させるので結局同じ構造になります。
その時の分子軌道を見てみましょう。
喧嘩し合っていた反結合性のπ結合が、一番邪魔し合わない直交位置にいる事がわかります。
これは、3重結合の所でも説明しました。炭素ー炭素の結合は同じ結合には2までしか電子が入れません。しかし分子軌道が直交するする場合には同じエネルギーレベルの分子軌道が許されます。
そして、その90°直交した構造は、HOMOのように安定な構造ではないので、吸収した光エネルギーを熱エネルギーに変えて、2面角を−90°、もしくは+90°回転させて安定化していきます。−90°か+90°かが同じ確率で起きるなら、Trans体を光異性化させると、cis体とTrans体が半々できます。
模式図で表すと次のようになります。
この、光異性化で、一番よく目にし、面白いのはアゾ色素でしょう。
例えば、ある色素が赤く見えるという事は、赤以外の光を吸収したという事です。
そして、光のエネルギーは、青い方が高く、ついで緑、そして赤色の順になります。(赤外線は暖かい程度だけど、紫外線は火傷することからも、感覚的に分かるでしょう。)
そこで、色素が赤く見えるというのは、「緑以上の光エネルギーを、HOMOからLUMOへの電子励起に使ってしまった」という事です。
そこで、アゾ色素の様々な位置にいろいろな置換基をつけて色合いを変えたものが合成されました。
その最大吸収波長λmaxはどうやったら予測できるでしょうか?
昔そうした検討が行われた時には、PPP(Pariser–Parr–Pople)分子軌道法というものが使われました。PPPはπ電子のみを考慮する方法で、原子は平面上に配置されます。(π軌道は平面に垂直な方向に置かれます。)
現在は使われる事はほとんどないでしょう。
ブラウザーとJAVAScript程度の計算でなら、コーディングする価値はあるかもしれませんが、さしああたってCNDO/2のプログラムはあるので、これで色素の計算ができるか試してみましょう。
大きな問題は、平面で表した分子と実際の3次元的な分子の問題だと私は考えています。
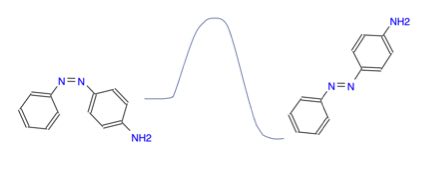
単純に描画すればこのように、シス体よりもトランス体の方がエネルギーが安定であるのは理解する事ができます。
しかし、このような平面構造が取れるかは、デジタル分子模型を使えばすぐにわかります。
シス体の分子を見てみましょう。
すぐにわかるように、シス体の平面構造を作ると隣同士のベンゼン環の2の位置の水素はぶつかってしまいます。
すなわち、2の位置に置換基などがついた場合には、さらに立体障害が大きくなり、両方のベンゼン環は2重結合の平面から大きくねじれて不安定な構造になります。
ですから、HOMO-LUMOのエネルギ差を見れば良いというほど単純なものでは無いのですが、さしあたって知りたいのは、様々な位置に置換基をつけたときに、「HOMO-LUMO遷移のエネルギーが最大吸収波長λmaxと相関があるか?」です。
様々な位置に置換基を入れた時のλmaxの値が文献にあります。
分子を組みたて、HOMOとLUMOの値を抜き出してみましょう。
| Sub | 1 Sub. λmax | NO2 λmax | CN λmax | HOMO | LUMO | L-H |
| None | 318 | -12 | 2.79 | 14.79 | ||
| 2-NH2 | 417 | -11.3 | 2.74 | 14.04 | ||
| 4-NH2 | 385 | -11.02 | 2.94 | 13.96 | ||
| 4-OH | 349 | -11.47 | 2.93 | 14.4 | ||
| 4-NEt2 | 415 | -10.73 | 2.94 | 13.67 | ||
| 4NMe2 | 408 | -10.58 | 2.91 | 13.49 | ||
| 4NO2 | 332 | -12.57 | 1.23 | 13.8 | ||
| 4NO2、4’OH | 386 | -11.89 | 1.23 | 13.12 | ||
| 4-NMe2、4’NO2 | 478 | -10.89 | 1.28 | 12.17 | ||
| 4-NMe2、2’NO2 | 440 | -10.81 | 2.17 | 12.98 | ||
| 4-NMe2、,3’NO2 | 431 | -10.82 | 1.26 | 12.08 | ||
| 4-NEt2、4’NO2 | 490 | -10.47 | 1.32 | 11.79 | ||
| 4-NEt2、4’CN | 466 | -11 | 2.47 | 13.47 | ||
| 4-NEt2、3’CN | 446 | -10.83 | 2.64 | 13.47 | ||
| 4-NEt2、2’CN | 462 | -11.05 | 2.83 | 13.88 | ||
| 4-NEt2、2′,4’diCN | 515 | -10.91 | 2.36 | 13.27 | ||
| 4-NEt2、2′,6’diCN | 503 | -11.09 | 2.23 | 13.32 | ||
| 4-NEt2、3′,5’diCN | 478 | -11.73 | 2.21 | 13.94 | ||
| 4-NEt2、2′,5’diCN | 495 | -11.77 | 1.91 | 13.68 | ||
| 4-NEt2、3′,4’diCN | 500 | -11.61 | 1.89 | 13.5 | ||
| 4-NEt2、2′,4′,6triCN | 562 | -10.39 | 1.96 | 12.35 |
官能基の群によって多少傾向が変わりますが、傾向としては最大吸収波長λmaxはHOMOからLUMOへの励起エネルギーと相関がある事がわかります。
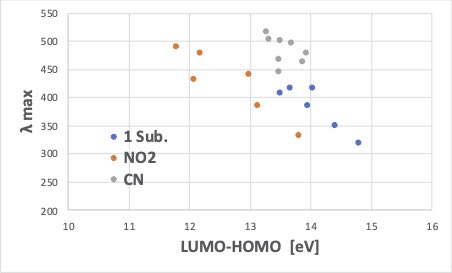
さらに細かい、置換位置の問題などをさらに詳しく調べていただきたいと思います。

色素増感太陽電池、有機EL素子の設計などで、こうしたHOMO-LUMO遷移エネルギーは重要な役割を果たします。
CNDO/2程度では正しく描写できているかは疑問ですが、金属結合を見るために、金属ナトリウムの体心立方格子を計算してみましょう。
この場合は原子数が9個で奇数です。価電子はナトリウムは1つなので、9個の電子が2つずつ分子軌道に入って行くと1つ余ってしまいます。
そこで、HOMOとLUMOの軌道エネルギーが同じになってしまいます。Upper ボタンとLowerボタンを使って確認してみてください。
分子軌道を作って安定化できないので、原子に束縛されずにフラフラ動き回れる自由電子になり、それが金属の導電性につながると説明されています。電子をひとつ失ったナトリウムはネオンと同じで方向性を持った結合を持たず、球が接触しただけの結合になり、それが金属の変形しやすさ(塑性)につながると説明されています。
興味があれば、Naの数を1つずつ増やして偶数や奇数にしながら格子を大きくして、エネルギーレベルを見て行くと良いでしょう。
1.分子構造の調整。
2.分子集合体の分子模型作成。 ちょっと計算が重いので注意
3.各原子上の電荷を計算。 ちょっと計算が重いので注意
4.ある温度における分子(原子)の運動。
5.π結合とσ結合の違い。
6.作られる直前の化学結合の様子。
7.HOMO-LUMO遷移エネルギーと化学結合。
8.振動解析結果のアニメーション。
9.デジタル教科書の作成。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
10.豊かな化学のために。
12.全フッ素化キュバンのLUMOが電子を閉じ込めた!
Webアプリ版、CNDO/2を使った教材作成について
「こういう教材を作りたいので、pirikaのアプリを使いたい」と言うご要望がありましたら、メールを頂ければ幸いです。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
