2011.5.29(2021.1.11改訂)
その他の化学トップページ> YNU-シミュレータ
HTNL+JavaScriptの手習で、昔作った(1990)Cのプログラムをブラウザー上で動くように改造した。現在では意味ないが、思い出の品として。
分子の電荷計算(電荷平衡法):
電荷平衡法(Charge(Q) Equilibration(Eq) : QEq)はカルフォニア工科大学のGoddard教授らにより1990年前後に提唱された分子中の原子の上の電荷を簡便に計算する方法です。
自分はGoddard教授の元に1990-1991年留学していた縁もあり、先生の論文を元にPC用に簡略版へ書きなおしました。
PC版のポイントは弗素原子の取り扱い(先生の論文ではフッ素のパラメータは、LiFなどの無機物の電荷を元にしているのでマイナスの値が大きすぎる)を有機物ベースに変えたことと、窒素原子などのパラメータを窒素の種類によって値を変えたことです。
自分で作成したパラメータは実測のダイポールモーメントを再現できるように調整を行いました。
それと、PCは処理能力が低いので、原子間の距離に応じて当てはめるポテンシャル曲面の計算を簡略化しました。
簡単に利用できる分、正式なものではありませんが、化学工学で扱う分には十分でしょう。(2011年から始まった横浜国大での授業は、化学工学系の学生が対象です。)
詳しい説明は、CMC出版、機能材料、2005年11月号、Vol.25 No.11 pp 5-42に特集記事があるのでそちらを参照してください。
多くの専門家が素晴らしい理論を構築して様々な分野へ応用されているのがわかるでしょう。
問題はいくら素晴らしくても、じゃー自分の分子を計算してみたいって思ったときに(その研究室に知り合いがいて計算してくれるならともかく)計算できない事です。
それなら精度は低くても簡単に計算できる方がいいというのがYNU-シミュレータのコンセプトです。
他のところでも書来ましたが、計算機化学を目指す専門家はきちんとしたものを使って欲しいと思います。
原理を簡単に紹介しましょう。
有機反応を行うときなど、有機合成屋さんは、”ここがδ+でここがδ-だから、あーなって、こーなって”という反応式を頭の中だけで自由にやってのけます。
その基礎は各原子の電気陰性度でしょう。
どのくらいδ-になりやすいかの尺度と考えれば良いでしょう。
有機合成屋さんは、フッ素で3.98,酸素で3.44と大きいので、これらの原子の上には電子がいっぱいあり、δ-がある。その分電気陰性度の小さい原子上にδ+がくるとかで判断しているのだと思います。
この概念はPaulingらによって初めて導入されました。
データブックなどに周期律表の全ての原子についてこの電気陰性度は記載されています。
Mullikenは電気陰性度が原子のイオン化エネルギー(I)と電子親和力(E)から
Χ=1/2(I+E)
という式で表せるとしました。
原子は結合を作る際に、電気陰性度が互いに等しくなるまで(平衡に達するまで)電子密度を変化させると考えました。
そこで、最初は全ての原子上の電荷が0から出発して、電子は電気陰性度の小さい原子から大きい分子へ流れます。
原子上に電子が貯まれば電気陰性度が低下します。
平衡に達すると各原子の電気陰性度は等しくなり電子の流れは止まります。
こうした繰り返し計算を行うのが電荷平衡法です。
これを古典力学を使って解くなら、実は3次元座標は必要ありません。
原子の結合様式がわかればいいです。
2次元のお絵描きから電荷を計算する例はこちらから。
しかし観測量であるダイポールモーメントなどは誘起される電荷を扱わなくてはならないので、3次元座標中のケミカルポテンシャルが一定になるまで電荷を移動させるGoddard教授の方法をここでは採用しています。
(実は窒素などの種類によってパラメータを変えたりしているので、両方のハイブリッドのような方法になります。)
難しい話はここまでにして、実際にYNU-シミュレータを使って実際に電荷計算を行ってみましょう。
YNU-シミュレータを立ち上げたら、まず最初に最初の授業で伝えるパスコードを入力します。(パスコードがないと使える原子はH, C, N, Oだけになります。)
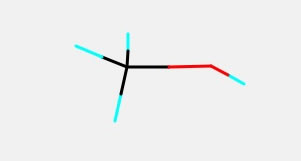
最初にメタノールの分子構造を作ってみましょう。
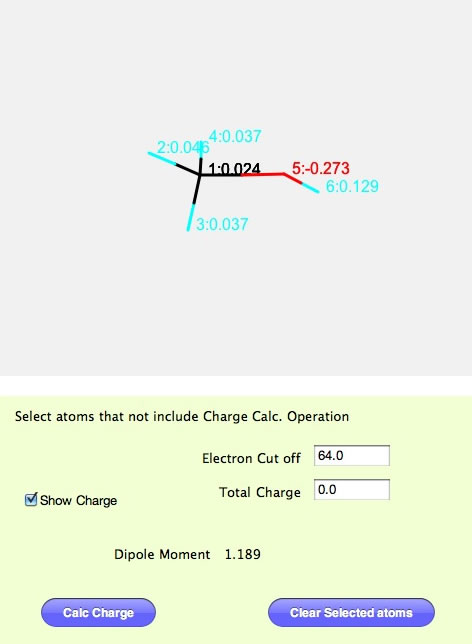
そして、電荷を計算するパネルへ行き、Calc Chargeボタンを押す。Show Chargeにチェックを入れると各原子上の電荷が表示される。その時のダイポールモーメントの値が表示されます。いろいろな構造を作って試してみてください。
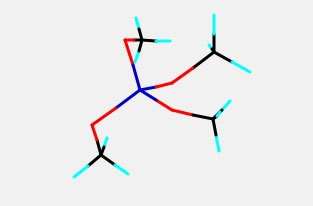
YNUのパスコードを持っている場合には、Si(OMe)4の構造を作ってみましょう。(WebユーザーはH, C, N, Oしか計算できません。)
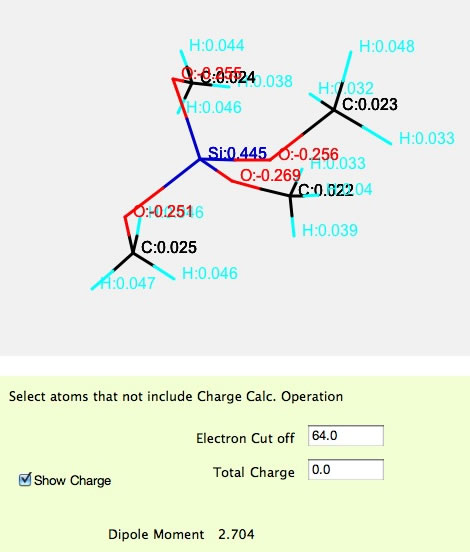
メタノールを計算するのとほとんど変わらない計算時間で電荷が計算できるのが判るでしょう。
化学工学の学生には必要ないので、塩素以降の原子は使えなくしてありますが、Atom typeでotherを選び元素記号を入れることによって、中心をTiに変えることもできます。
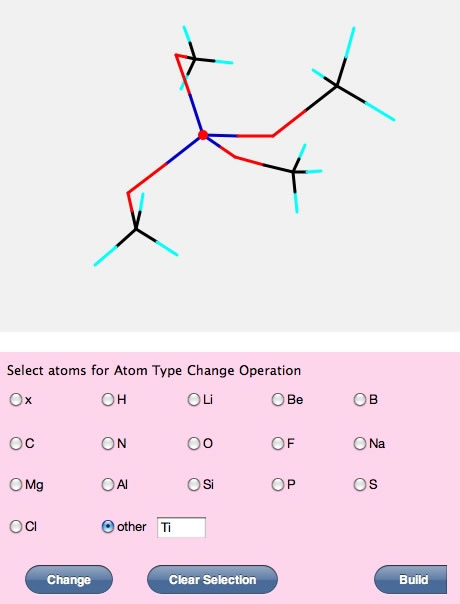
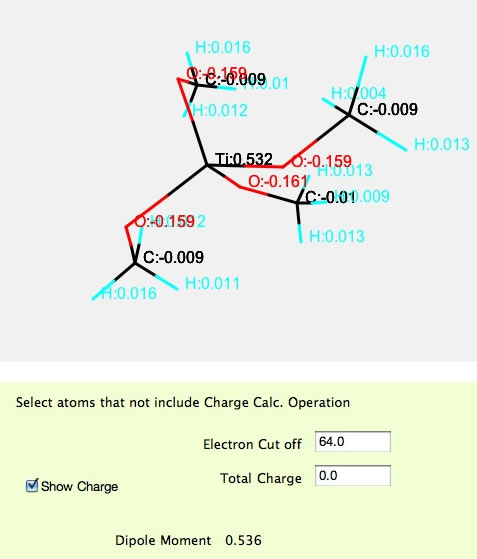
塩素より大きい原子の電荷平衡法の検証はまだ完全ではありませんが、こうした計算が瞬時に、遷移金属まで含めた周期律表103番原子、Lrまで、できるのが電荷平衡法の特徴です。
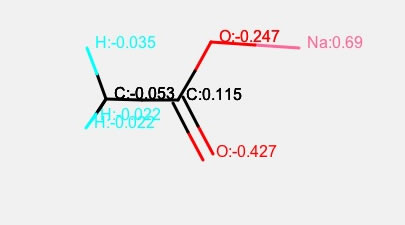
酢酸のナトリウム塩を計算すると上のようになります。MOPACなどで計算しても、アルカリ金属は電荷が+1(Sparkle Atom)になってしまうので、電荷平衡法の方が都合が良い例です。
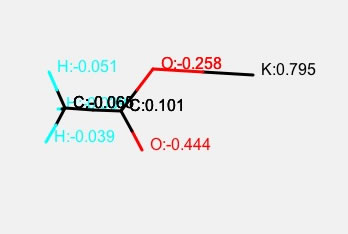
カリウム塩に変えると上のようになります。
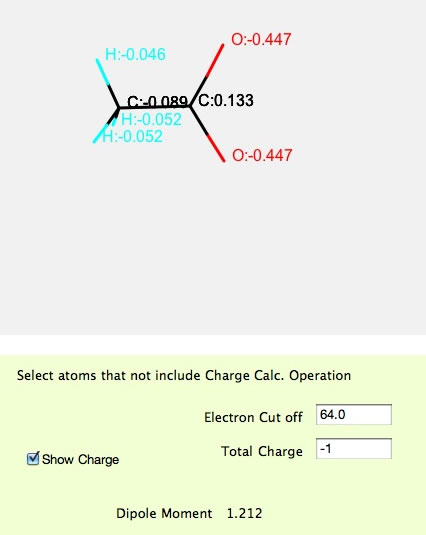
また、酢酸イオンの場合には、Total Chargeを-1に指定して計算を行うと上記のような結果になります。二つの酸素は等価になり、電荷は等しくなります。
実際に計算して試してみてください。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
