2024.9.04
pirika.comで化学 > 化学全般 > 化学工学 > 復刻版:ASOGによる気液平衡推算法 > 第1章 溶液論の基礎式 >
1.1 理想溶液
ある液体があった時に,液体の中では分子が運動し,お互いがぶつかり合っている。その様子を花粉の動きで観察したのがロバート・ブラウン(1827年:ブラウン運動)だ。気体と違って液体は非常に混み合っていて,少しでも動くと他の分子に衝突する。衝突によって,液相からはじき出された分子は気相に飛び出す。そうした気体が壁に衝突する事で圧力が観察される。これが蒸気圧だ。液体の温度を高くしていくと,分子の運動が激しくなり,気相に飛び出る分子も多くなる。また、気相から液相に戻る分子もある。
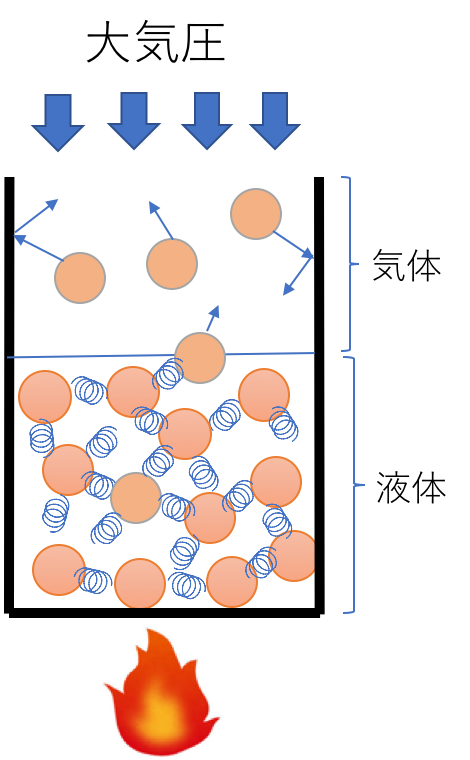
この蒸気圧が大気圧と等しくなった点を標準沸点と定義する。この温度と蒸気圧の関係をプロットしたものが蒸気圧線図だ。圧力は指数関数的に大きくなるので、蒸気圧の軸は対数(log)を取ることが多い。例としてエタノールの蒸気圧線図を次に示す。
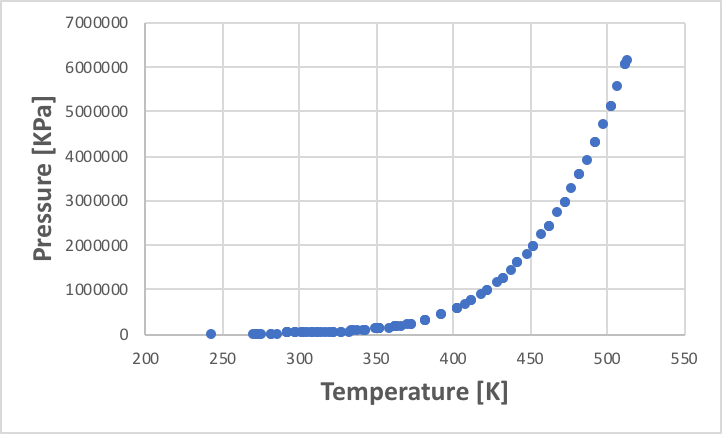
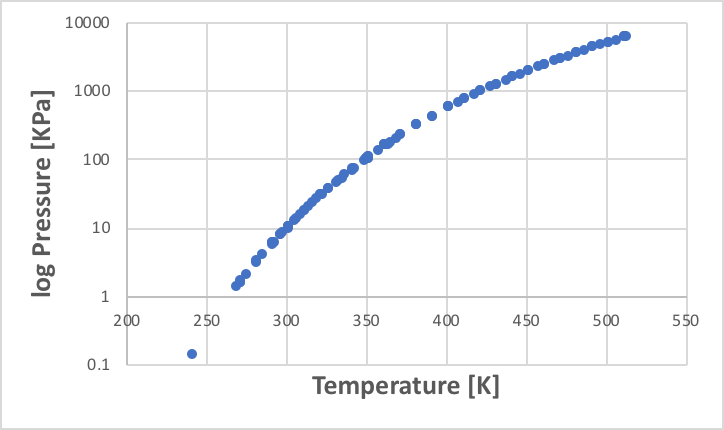
ある液体の蒸気圧は、温度が決まれば1つに決まる。ところが、混合物になるとそう簡単ではない。例えば水は100℃で沸騰するし、エタノールは78.2℃で沸騰する。それでは、エタノールの50%モル水溶液は何度で沸騰だろうか?
(100+78.2)/2で89.1℃だろうか?
理想溶液では「任意の成分の蒸気圧は、その成分が単独で存在する時の蒸気圧に溶液のモル分率をかけたものに等しくなる」というラウール(Raoult)の法則が成立する。
全圧力P=P1*x1+P2*x2 ラウールの法則
(2成分系では、x2=1-x1になる。)(1-1)
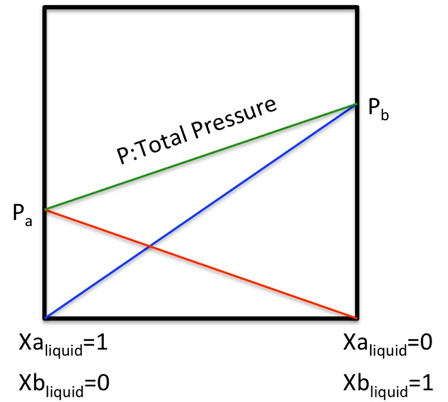
つまり、どんな濃度比で混合しても、2成分の液相の比率と気相の比率は下図のように同じになる。
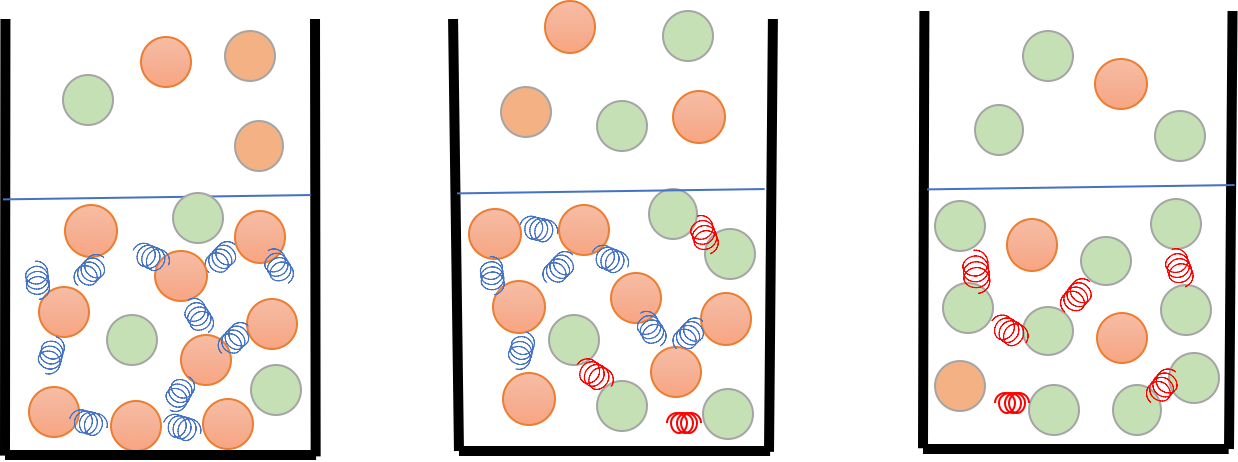
そこで、「エタノールの50%モル水溶液は何度で沸騰するか」という問いには、
大気圧=Pエタノール*0.5 + P水*0.5
となる温度を求めればいいわけだ。
ある温度Tでの圧力、Pエタノール、P水を蒸気圧線図から読み取るのは大変なので、この蒸気圧曲線を温度の関数として表したものを使う。最も著名な相関式としてAntoine蒸気圧式という式がある。
水:logP(mmHg)=7.4155-1348.12/((T[℃]+197.68) ) (1-2)
エタノール:logP(mmHg)=7.5424-1286.85/((T[℃]+197.20) ) (1-3)
こうした式があれば、任意の温度T(℃)での圧力、Pエタノール、P水が求まる。
先ほどの平均値の89.1℃で蒸気圧を計算すると、水(518.34mmHg)、エタノール(1115.93mmHg)となり、ラウールの法則で計算した混合液の蒸気圧は817.14mmHgになる。
少しだけ大気圧(760mmHg)より大きくなってしまう。
85℃では、701.59mmHgで小さくなりすぎ。
88℃では、784.72mmHgでちょっと大きい。
87.135℃で759.97mmHgとほぼ760mmHgになる。
このように適当な温度を入れて計算して、結果を見て温度を増減させて最適な温度を求めるやり方を収束計算と言う。手作業でやると大変だが、Excelのソルバーなどを使えば簡単に答えが求まる。
大事な点は、沸点近傍では(89.1-87.135)=1.965℃温度が変化しただけで、蒸気圧は817.14-760=57.14mmHg変化してしまうことだ。
1℃あたり約30mmHgに相当する。この事は頭の片隅に留めておくと良い。
さて、エタノールの50%モル水溶液が87.135℃で沸騰したとすると、気相はどのような組成になっているだろうか?
ここでの仮定としては、「大気圧程度の低圧では、気体は理想気体として振る舞う」を使う。
次節:1.2 理想気体へ
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
