2024.9.04
pirika.comで化学 > 化学全般 > 化学工学 > 復刻版:ASOGによる気液平衡推算法 > 第2章 ASOG法
2.2 ASOG法による気液平衡の計算式
多くの場合、気液平衡測定は、圧力一定でモル分率を変化させて、一定圧力に到達する温度を求める。圧力は大気圧の事が多いが、沸点が高い化合物の場合は減圧にして測定することもある。また、温度一定でモル分率を変化させて、圧力の変化を測定する場合もある。このように、圧力一定で、液相のモル分率に対して気相のモル分率と温度を求める。もしくは、温度一定で液相のモル分率に対して気相のモル分率と圧力を求めることを、実験で行うのが気液平衡の測定で、コンピュータでやるのが気液平衡の推算だ。
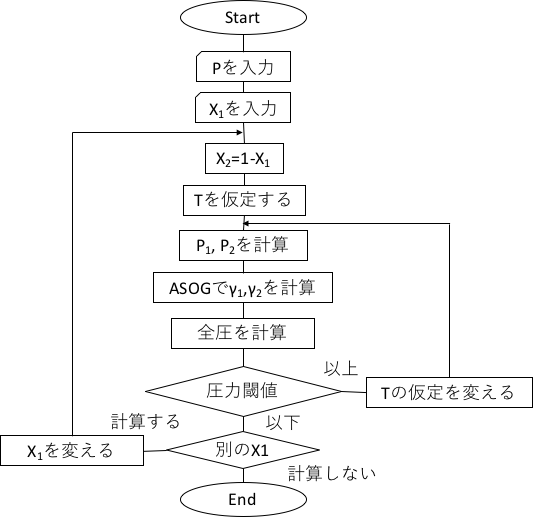
活量係数γiは、モル分率xiと温度の関数になる。モル分率xiは0-1.0まで、例えば0.02刻みで指定することにする。モル分率が0ということは1成分目が0ということなので純粋な水、モル分率が1というのは純粋なエタノールになる。(気液平衡の世界では慣習として沸点の低い方を第一成分にする。)純粋なエタノール、水は計算しなくて良いので、モル分率xiは0.02から計算していく。モル分率が決まると、液相中のグループlのグループ分率Xl(システムの中に存在するグループの分率)が決まりる。モル分率が0.02では、エタノールは非常に少ないので、XCH2やXOHは非常に小さな値になる。このグループ分率Xlとグルーブ間相互作用パラメータaklが決まると、グループkのグループ活量係数Γkが決まる。
ここで問題になるのが、温度だ。グルーブ間相互作用パラメータln akl = mkl + nkl⁄Tのうちmklやnklはデータベースから持ってくるとしても温度T(K)が決まらないとaklを得る事ができない。そこで、プログラム上は、グループ活量係数Γk=関数(xj、T)のような形にしておく。モル分率と温度を指定した時にグループ活量係数が決まるようにしておくわけだ。実際にはどうやって温度Tを決めるのだろうか? 1.1でやったように、100(水沸点)*(1-X1)+78.2(エタノール沸点)*X1と初期値の温度を仮定して活量係数γiを計算する。そしてラウールの法則の実在溶液版、
P=P1*γ1*x1+P2*γ2*x2
に入れて全圧を計算する。計算値が大気圧より大きければ、温度Tを小さく、大気圧より小さければ温度Tを大きくして、大気圧と同じになる温度Tを収束計算で求める。それを組成の全範囲で計算すれば、気液平衡を推算したことになる。ここで、ある温度での純成分の蒸気圧を計算するのに、純成分の蒸気圧式が必要になる。これも成分を選べば、決まる物性値なので、純成分のデータベースにAntoine定数を入れておくことにする。
圧力一定の場合のASOG法推算のフローチャートを示しておく。
vj^FH とvkiとAntoine定数は純成分データベースに登録する。
グルーブ間相互作用パラメータaklはASOGパラメータデータベースに登録する。
蒸気圧式のAntoine A, B, Cは純成分データベースに登録する。
それさえできていれば、任意の組み合わせで、最初に行いたかった事ができるようになる。
(本来であれば、ギ酸、酢酸などは気相会合するとして扱わなくてはならないが本書のバージョンでは対応していない。)
任意の混合溶媒の組成が変わった時の沸点と気相組成を予測する事ができる。
それは、ASOG法を使えば、任意の溶媒ペアのある混合比率、ある温度での活量係数を知る事が可能になるからだ。
次節:2.3 実際のASOG法計算
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
