2024.9.04
pirika.comで化学 > 化学全般 > 化学工学 > 復刻版:ASOGによる気液平衡推算法 > 第1章 溶液論の基礎式
1.4 活量係数の算出
ある溶媒ペアの活量係数γ1 γ2を求めるには、液相の濃度を少しずつ変えて、気相の組成と沸点を測定した実験データが必要になる。例えば、エタノール/水の気液平衡の実験データは次のテーブルのような形で得られる。X1がエタノールの液相中の分率、Y1が気相中のエタノールの分率になる。
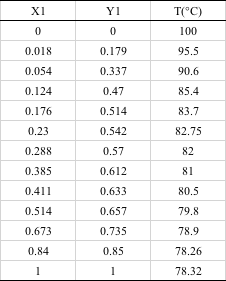
この表のデータを図示してみる。1つ目はX-Y線図と呼ばれるものだ。Xは第1成分の液相のモル分率、Yは第1成分の気相のモル分率を表す。
エタノールが気相に飛び出したがっているのがよくわかる。
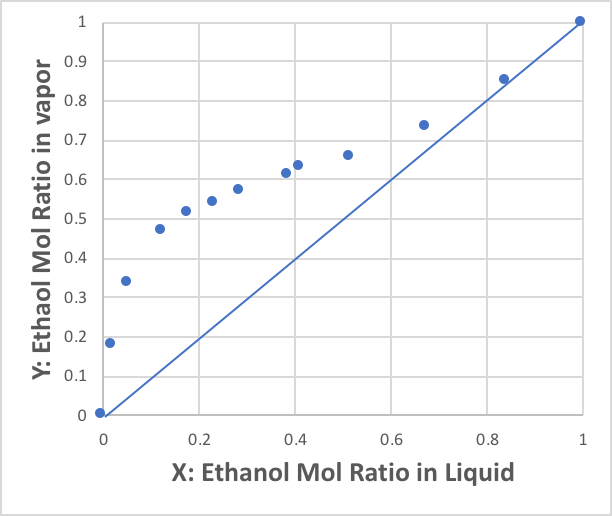
2つ目はX-T線図と呼ばれるものだ。横軸はX-Y線図と同じ第1成分の液相のモル分率ですが、Yは沸点を表す。
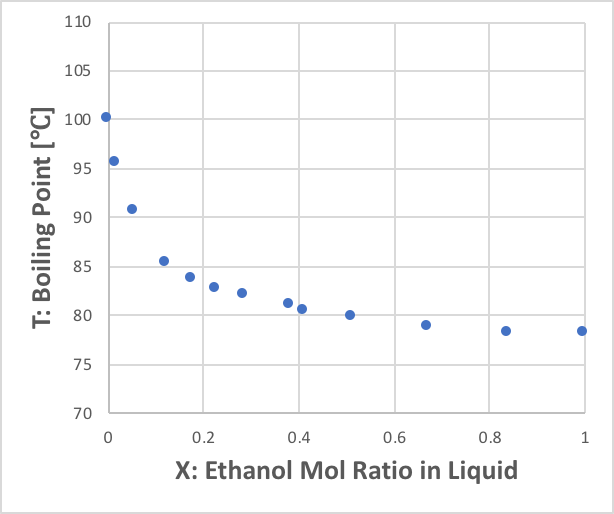
沸点はエタノールのモル分率が増えるに従って急激に下がることがわかる。これは、水の水素結合のネットワークが、エタノールが入ることによって破壊されて、低い温度でも水分子が液相から気相に飛び出すことが可能になっている事を示している。
では、次に、実際に活量係数γ1 γ2を求めてみよう。
表の最初と最後の行は純成分なので計算する必要はない。2行目を見るとこの分率では95.5℃で沸騰するとある。95.5℃でのエタノールの蒸気圧は、1446.9mmHg, 水の蒸気圧は645.7mmHgになる。
P=P1*γ1*x1+P2*γ2*x2に当てはめると、
760=1446.9*γ1*0.018+645.7*γ2*0.982
になる。
またその時の気相組成分率Y1は0.179なので、
0.179=1446.9*γ1*0.018/760が成立する。
そこで、各分率の時のγ1、γ2は簡単に計算することができる。結果をグラフで表示すると次のようになる。エタノールがほんの少量水に混合している(図の左端)状況では水の活量係数は、ほぼ1になるが、エタノールの活量係数は、5以上になる。つまり、水に囲まれたエタノール分子は、その場に居たくないということだ。本来であれば、95.5℃の温度では、1446.9mmHgの蒸気圧を持つのだが、その5倍以上も気相に逃げだす事を示している。
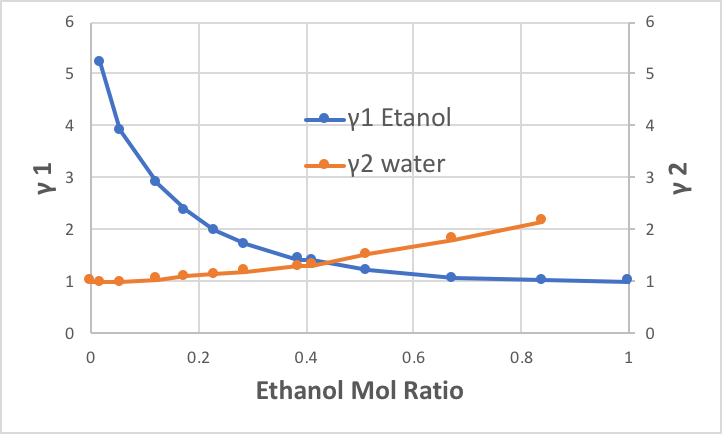
逆に図の右端の方では、エタノールの活量係数は1になるが、水の活量係数はそれほど大きくはなっていかない。水はエタノールに囲まれていても、それほど居心地が悪くない事を示している。
実験値として、正確な値、例えば、x1=0.5が求まっていなくても、これらのチャートから値を読み取ることができる。
次節: 1.5 活量係数式
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
