2024.9.04
pirika.comで化学 > 化学全般 > 化学工学 > 復刻版:ASOGによる気液平衡推算法 > 第2章 ASOG法 > 2.3 実際のASOG法計算
2.3.2 不均一系
理想溶液からの偏倚が大きい系,例えばnブタノール-水系,メチルエチルケトン-水系などでは,液体同士が混じり合わない。すると、液相が2相に分かれてしまうので、気液液平衡になってしまう. こうした系では、1.6 気液平衡の基礎式で説明したフガシチーの考え方が必要になる。
fiV (気相中の成分iのフガシチー)
=fiI (I液相中の成分iのフガシチー)
=fiII (II液相中の成分iのフガシチー) i=1,2, …, N (2-7)
ここに上付Vは気相,IとIIは2つの液相,I液相とII液相を表す.
フガシチーの定義を思い出そう。フガシチーとは「相からの逃げ出しやすさの傾向」で「平衡状態ではそれらが釣り合う」だった。そこで次の式が成立する。
fiV = Pyi =γiI xiI PiS = γiII xiII PiS i=1,2, …, N (2-8)
xiI , xiII はIおよびII液相中の成分iのモル分率, γiI , γiII はIおよびII液相中の成分iの活量係数だ.
簡単に言えば、i成分が「I液相からの逃げ出しやすさの傾向」と「II液相からの逃げ出しやすさの傾向」は等しく、さらに、「気相からの逃げ出しやすさの傾向」とも等しい、だ。
Gibbsの相律(Phase rule)というものがある。これは平衡状態に達した時の、成分、相の数と、状態量(温度、圧力)の自由度の関係を表す。
F(自由度)=C(成分数)-P(相の数)+2
例えば、1成分の気液平衡では、自由度= 1(成分)- 2 (気液相)+ 2 = 1となる。
そこで、温度を決めれば圧力が求まるし、圧力を決めれば温度は決まる。自由度が1ということは、自由に変えられるのは1つだけになる。
2成分の気液平衡では、自由度は2になる。状態量の1つであるモル分率と温度、もしくは圧力が決まれば、残りは決まる。
液相が2相に分かれてしまうと、自由度 = 2(成分)- 3 (気液相)+2 = 1となる。
つまり、モル分率を決めると、温度も圧力も決まってしまう。
メチルエチルケトン-水系で確認してGibbsの相律の意味を理解しておこう。
(70) Methyl Ethyl Ketone(MEK)_Water系を選択し、MN1979で計算を行う。
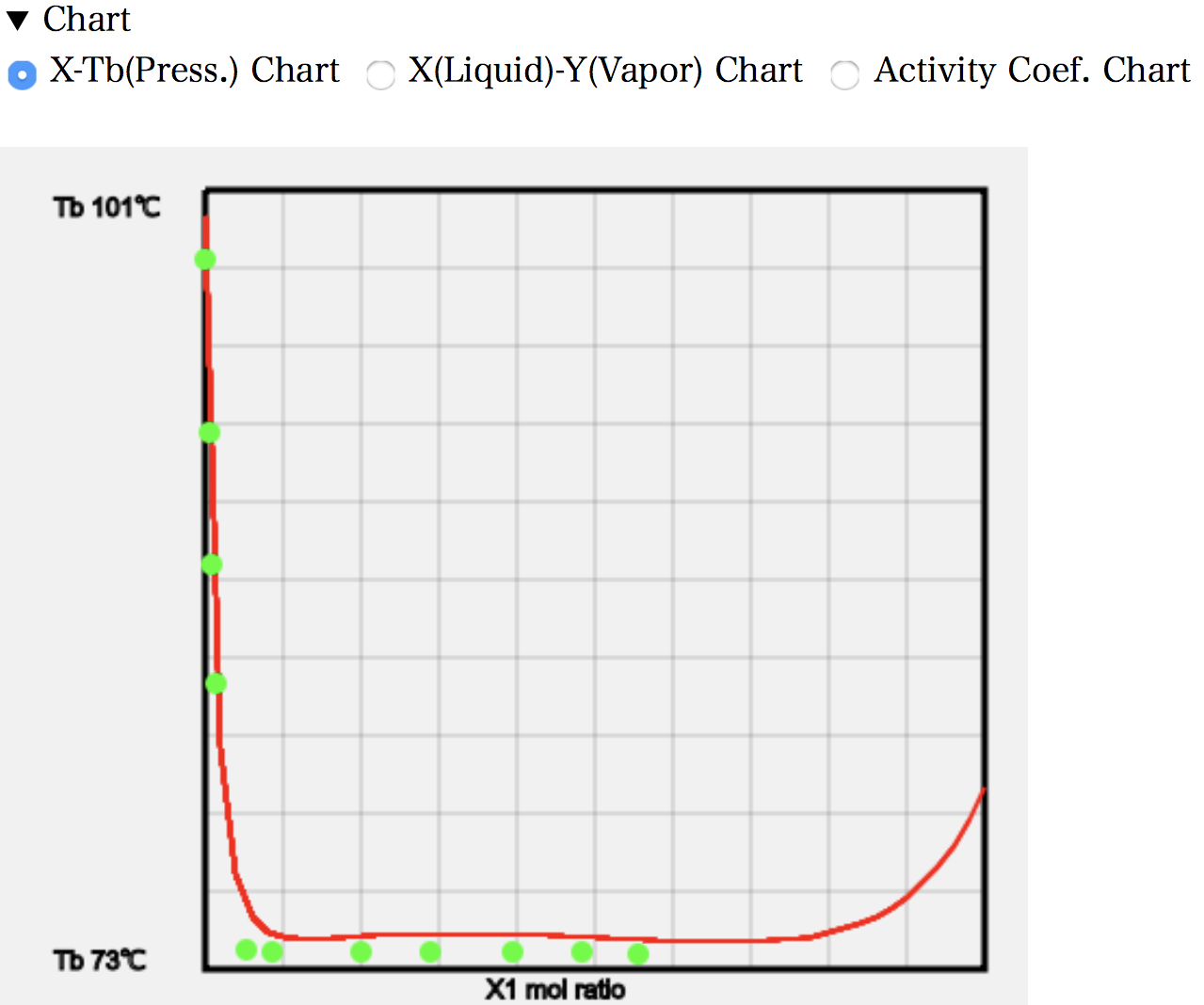
X-T線図を見ると、MEKが増えてくると(図の左端)沸点が急激に小さくなることがわかる。これは水の水素結合が急速に失われていくことを示している。そしてその後は広い範囲で温度は変わらなくなる。この測定は圧力一定の実験だ。つまり、モル分率を決めると、温度も圧力も決まってしまう自由度1の系になる。
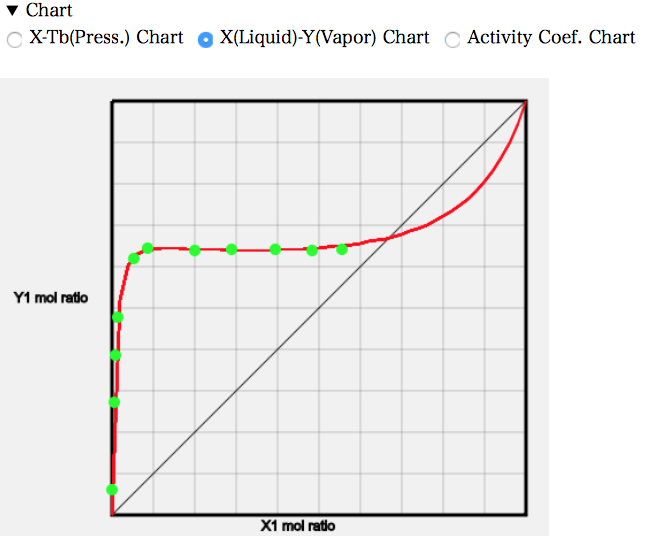
X-Y線図を見ると、MEKのモル分率が0.08ぐらいから、気相のMEKのモル分率がほぼ一定になる。
MEKは水100gに対して25℃で22.3g溶解する。水の分子量は18, MEKの分子量は72.1なのでモル分率としては0.053になる。温度が高い分、もう少し多く溶けてモル分率が0.08あたりから、MEKの液滴が発生することになる。それよりもMEKを増やして行っても第1液相のMEK/水の比率は0.08で変わらず、第2液相のMEK相が増えていくだけになる。そこで、MEKのモル分率が増えても、気相のMEKのモル分率は増えなくなる。
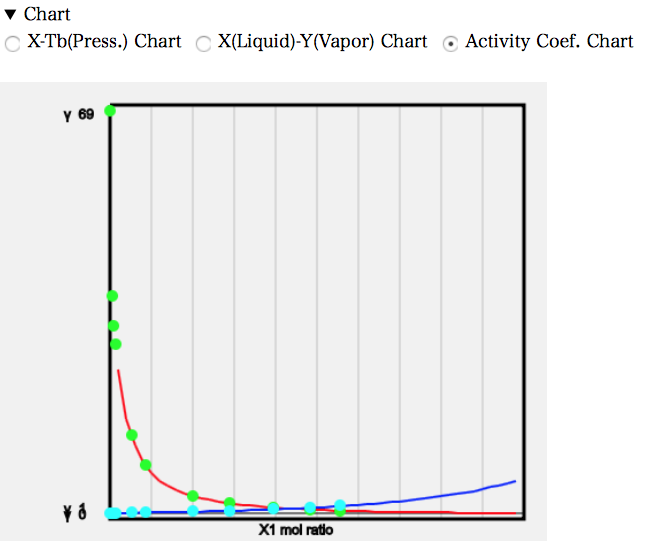
実際にはMEKに対する水の溶解度も0ではないので、フガシチーから求めた不均一系の活量係数式に従う。その時の活量係数のチャートは次のようになる。
MEKの活量が低い濃度で非常に大きくなっていることがわかる。一般的に活量係数が10を超えるような溶媒ペアは混じり合わないと言われている。ASOG法で採用されているWilsonの活量係数式は均一系のみに適用できるとされているが、かなり良好な結果になっている。
このように、溶媒ペアを2つ指定するだけで、気液平衡が計算できる。その結果を見れば、どのような混合状態になっているのか分かるというのが、ASOG法の大事な特長だ。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
