2024.9.04
pirika.comで化学 > 化学全般 > 化学工学 > 復刻版:ASOGによる気液平衡推算法 > 第2章 ASOG法 > 2.3 実際のASOG法計算
2.3.3 気相会合系
低分子のカルボン酸はダイマーで蒸発することが知られている。カルボン酸は水素結合性の化合物で元々理想溶液からは外れるものだ。もしカルボン酸が水やアルコールのように3次元の水素結合ネットワークを作っているのなら特別扱いする必要はない。
カルボン酸の特異性はダイマーを作ってしまい、その水素結合が非常に強く、蒸発しても気相中でダイマーのままでいることだ。COOHの極性部分がキャンセルしあい、あたかも非極性の1つの分子のように振舞う。そうするとどのような事が起こるのだろうか?
理想気体のボイル・シャルルの法則によれば、PV=nRT (n:モル数、R:モル気体定数)が成立する。簡単のため、気相では100%会合しているとしよう。
温度、圧力、体積が決まれば気相中にいる分子のモル数は一定になる。2分子であたかも1分子のように振舞っている時のモル数は、見かけ上は会合していない分子のモル数と同じになる。しかし、ガスクロマトグラフィーなどで定量したときには、2倍のモル数が気相に存在していたことになる。そこで、気相中でどれだけ会合しているかの平衡定数が必要になる。
平衡定数というのは、2A ⇆ A2という平衡反応があった時に、どのくらいの割合になるかを示す定数だ。
代表的なカルボン酸化合物の気相会合平衡定数の実測値は次のようになる.
ギ酸 log K= -10.743 + 3083.0/T (323 K ~ 423 K) (2-9)
酢酸 log K =-10.931 + 3347.0/T (323 K ~ 423 K) (2-10)
プロピオン酸 log K= -10.834 + 3316.0/T (323 K ~423 K) (2-11)
実際にこの定数を使って何をするのだろうか? 先の2.2.3 不均一系で取り扱った、気液液平衡と同じように、気気液平衡を考えて、「相からの逃げやすさの傾向」フガシチーを使って式を組むことになる。
本来であれば、次の3つの平衡定数が求まっていないと2成分系の気液平衡は求まらない。
2A ⇆ A2
2B ⇆ B2
A+ B⇆ AB
オリジナルのプログラムを読むと、そのような対応がなされている。そして平衡定数はマニュアルでインプットするようになっている。しかし、ギ酸、酢酸、プロピオン酸以外の平衡定数は示されていない。また、カルボン酸だけの平衡定数だけを入れても、書籍に記載の結果を見ると他のグループのものと比べ大きな誤差を持つ。このような事もあり、本書のプログラムでは気相会合には対応していない。
例題の中でカルボン酸が関与するもののリストは次のようになる。
(21)(22)(23)(24)(48)(72)(73)(102)(103)(104)(114)
試しに、(21) Acetic Acid/Octane を計算して見よう。
モル分率が中央のあたりで大きく乖離していることが分かる。
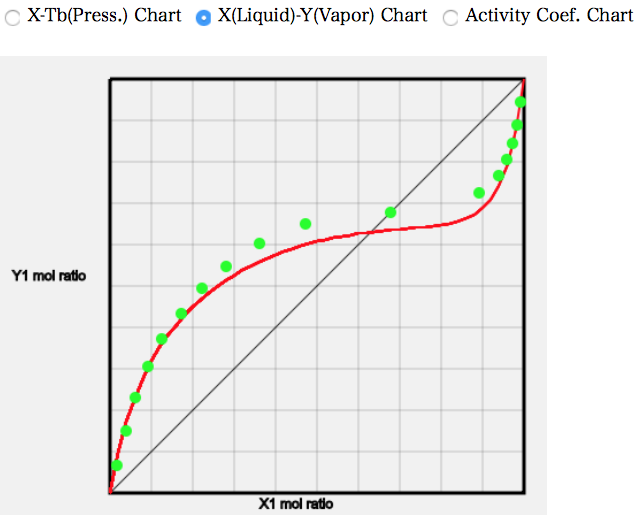
このように、基本的にはカルボキシル基を持つ溶媒は大きな誤差を持つ。
この差分だけ多くの会合した酢酸が気相にいることになる。逆に言えばこうしたデータが集まれば、気相会合定数を決定できることになる。
分子が大きくなると気相では開裂してしまうので普通の極性分子になる。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
