2020.12.12
このページは、「化学と教育」への寄稿と連動しています。
高校生、高校の教師向けのページですが、フィードバックを頂ければと思います。
その他の化学トップページ > 化学結合と温度
私たちは、物質に熱をかけると膨張することを知っています。
例えば、水の25℃での密度は0.99704g/cm3ですが、99℃での密度は0.95906g/cm3です。
つまり、4%近く分子体積が大きくなっています。
この熱膨張、水が持っている酸素-水素結合が4%伸びているのかというとそういう訳ではありません。温度の上昇とともに分子が激しく動いてぶつかり合い自分の領土を広げた結果、分子体積が大きくなったのです。
しかし、水とほぼ同じ沸点を持つn-ヘプタン(BP:98.43℃)の場合は25℃から100℃で11%近く体積が膨張します。
この違いは何故起こるのでしょうか?
つまり、n-ヘプタンは同じ100℃の温度を与えても、水より激しく動き回っているのです。n-ヘプタンの方が、分子量が大きく動きにくい筈なのに。
逆に言えば、水には分子の運動を妨げる「何か」があると考え、先人はそれを「水素結合」と名付けました。水、アルコール、カルボン酸、アミンなどが持つ化学結合です。
水素結合の強さは、沸点や蒸発潜熱などから定量的にわかります。
Troutonは様々な化合物の沸点と沸点における蒸発潜熱(1molの液体を気体に変えるのに必要なエネルギー)の間に相関がある事を見出しました(トルートンの通則、1884年)。 詳しくはこちらのページを参照してください。
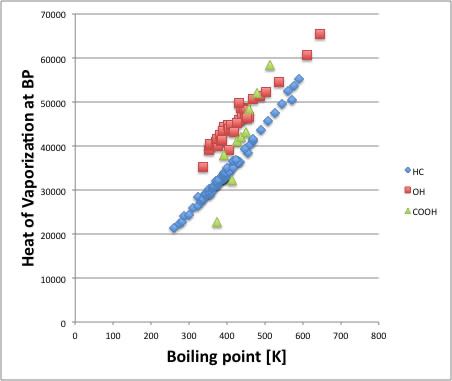
HC(炭化水素化合物)については沸点と蒸発潜熱には非常にきれいな関係があることがわかります。 分子が大きくなれば、その分沸点も高くなりますが、蒸発潜熱も同じように高くなるという事です。オレフィン、エーテル、ケトン、エステルなどの化合物も皆、炭化水素化合物(Hydro Carbon)の線上に乗ります。そのような行儀の良い溶媒のことを正則溶媒と呼びます。
アルコール化合物(OH)に関してはHC化合物の直線とほぼ平行にはなりますが、同じ沸点であればより大きい蒸発潜熱が必要になります。 その余分に必要なエネルギーが水素結合を切断するのに必要なエネルギーになります。
カルボキシル基を持った化合物は分子が小さいと、2分子で水素結合を作ります。
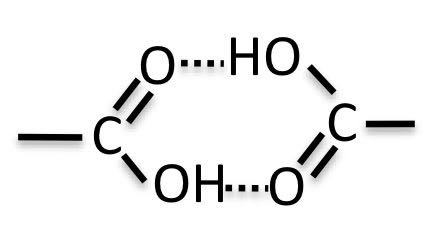
そして2量体(ダイマー)で蒸発するので、見かけ上、非極性の分子になり、非常に小さなエネルギーで蒸発します。
分子が大きくなるとアルコールなどと同じ3次元の水素結合ネットワークを作り、蒸発に大きな蒸発潜熱を必要とするようになります。
異分子間の分子間相互作用は、結合と呼べるほど強固で方向性を持ったものはありませんが、後ほど取り扱います。
沸点を超えて、さらに温度が高くなるとどうなるでしょうか?
ある液体を25℃から、どんどん温めていくと、沸点を超え(気体にならないように圧力をかけますが)臨界点(Critical Point)という気体でも液体でも無い状態にたどり着きます。
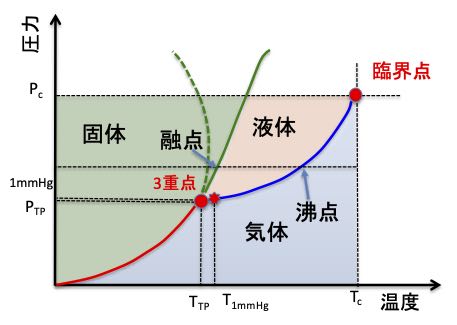
次にpirika.comの物性化学のページ「沸騰の科学11」から引用した図を示します。
臨界点での分子体積を臨界体積(Vc)と呼びます。
すべての化合物で、図のように臨界体積(Critical Volume)は25℃の分子体積の3倍になります。水でもアルコールでも炭化水素でも同じです。
もちろん、結合長が3倍になった訳ではありません。
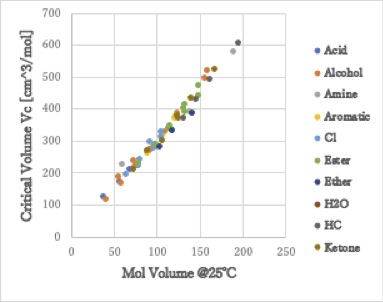
25℃から臨界温度(Tc)までの温度差は化合物によって異なるので、これは非常に不思議なことです。
臨界温度では、分子が激しく運動し、分子は25℃の時の3倍の領土を確保し、水素結合など分子間に働く力、分子の内部に持つ力と釣り合っているということです。
何故「25℃の時の分子体積」なのかは、私には合理的に説明できません。
こうした分子の重心の3次元的な動きを取り扱う計算機化学の方法を分子動力学法(MD法; Molecular Dynamics)と呼びます。pirika.comでは無機物のMDを扱っています。
次に分子の中の化学結合への温度の効果を考えてみましょう。先ほど出てきたn-ヘプタン(C7H16)はCH3CH2CH2CH2CH2CH2CH3という構造を持ち、C-C結合を6個、C-H結合を16個持ちます。n-ヘプタンには構造異性体(組成C7H16が同じだけれど構造が異なる)が8つ存在します。
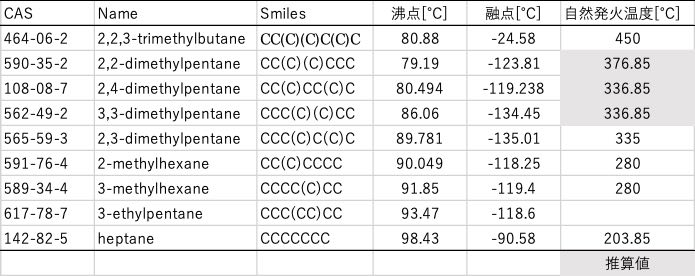
例えば2,2,3-trimethylbutaneの沸点はn-heptaneよりも、17.6℃も低くなります。分子の持っている化学結合は同じです。傾向を見ると枝分かれの多い構造の時に沸点は低くなります。枝分かれが多くなると何故沸点は下がるのでしょうか?
試しに化学系の大学院博士課程前期1年生に聞いてみました。
「分子の枝分かれが多いと、分子が球状になり、分子同士の接触面積が減り、抵抗が少なくなるので沸点が下がるのだと思います。」
見事な答えです。
では、何故炭素が7つ環状に結合したシクロヘプタンはn-ヘプタンより20℃も沸点が高いのでしょうか?
シクロヘプタンの方が球形に近いはずです。
さらに、ヘプタン類を酸素の存在下で温度を上げて行くと自然発火(火種が無くても燃え始める)を起こします。枝分かれの多い構造は、この自然発火温度がn-ヘプタンより246℃も高くなります。枝分かれが多いと何故自然発火温度が高くなるのでしょうか?
ちなみに、ディーゼルエンジンは、燃料を断熱圧縮して自然発火温度以上にして燃焼させ、膨張エネルギーをピストン運動に変換します。その際に自然発火温度が低い燃料が混じっていると圧縮が完了する前に燃焼が起こり、ノッキングという現象につながります。
逆に温度を下げて行くとどうなるでしょうか?水は0℃で氷になります。ヘプタン類はn-ヘプタンの融点が-90℃付近で、枝分かれが多くなるにつれさらに30℃近く融点が下がります。ところが一番枝分かれが多い、2,2,3-trimethylbutaneは融点-24.6℃と逆に65℃も高い融点を示します。
何故でしょう?
こうした何故に答えるために、先人たちは、原子がバネで繋がれているモデルを考案しました。バネは結合方向、結合角方向、ねじれ角方向で、異なるバネ定数が定められます。
こうした分子の内部の動きを取り扱う計算機化学の方法を分子力学法(MM法:Molecular Mechanics)と呼びます。
n-ヘプタンの液体中では、分子は3次元的に動き回るだけではなく、様々な結合長、結合角、ねじれ角になりながら振動しています。温度が高くなると回転障壁を乗り越えて高い内部エネルギー状態になる確率が高くなります。
そこで、液体が大気圧に逆らって気体になる沸点の温度は、振動エネルギーの分、高い温度が必要になります。
2,2,3-トリメチルブタンは次のような構造になります。
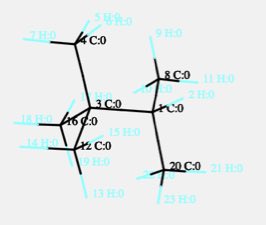
重原子間で回転できるのは、炭素1と炭素3の結合だけです。
非常に混み合っているので、結合長、結合角の振動も大きくありません。
そこで、内部で使われるエネルギーが小さいので、低い温度で沸騰することになります。
それでは、自由には結合をねじれない環状化合物はどこに振動エネルギーを使って沸点が高くなっているのでしょうか?
環状のシクロヘキサンは、室温で、1秒間に100,000回この振動を繰り返しています。
環が大きくなると、さらに色々な配座が取れるので、シクロヘプタンではさらに沸点は高くなる方向になります。
自然発火温度に関してはどうでしょうか?
燃焼というのは、ラジカルの連鎖反応です。熱によって、ある結合が激しく振動して、ある限度以上の振動で切断されます。原子をつなぐバネが壊れた状態だと思って下さい。そうしてできたラジカルが、また分子から原子を引き抜いてラジカル脱離が連鎖します。
その時に重要なのはメチル基の水素は非常に引き抜かれにくいという事です。例えばメチル基が2つでできているエタンの自然発火温度は、472℃になります。
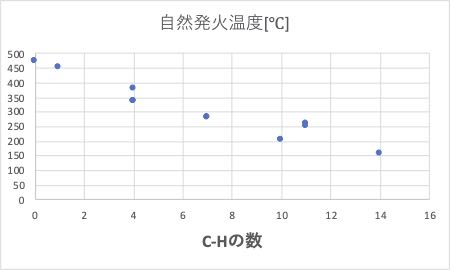
そこで、メチル基以外の、C-H結合の数に対して、自然発火温度をプロットすると上図のようになります。
メチル基を持たない、シクロヘプタンの自然発火温度は155℃と最も低くなります。
オゾン層がCFC(クロロ・フルオロ・カーボン)によって破壊されるというフロン問題がありました。
分子中に水素を持たないCFCは、不燃性で毒性もなくとても優れた溶媒(発泡剤、冷媒)でした。ところがこのCFCが成層圏まで上がっていくと、強い紫外線のためCFCが壊れ、塩素ラジカルを発生し、オゾンを連鎖反応的に破壊する事がわかりました。そこで特定フロンは1996年に全廃されました。
大気圏には水酸基ラジカルが大量に存在します。そこで分子中に水素を持つ、HCFCが暫定的に使われることになりました。分子中にC-H結合を持つと、その水素はOHラジカルで引き抜かれ、燃焼と同じように大気中でどんどん分解していきます。
そこで、化合物の大気寿命を予測するには、OHラジカルとの反応速度が大事になります。
自然発火温度と同じで、メチル基(CH3)のC-H結合は強いので、OHラジカルではほとんど引き抜かれません。そこでメタンは大気圏では分解されにくく、地球温暖化ガスとして問題になっています。HCFCもその水素の導入位置など様々に工夫が必要ですが、大気寿命が短いという事は燃焼性が高いことにもつながり、分子設計は簡単ではありません。
融点については次のように説明されています。
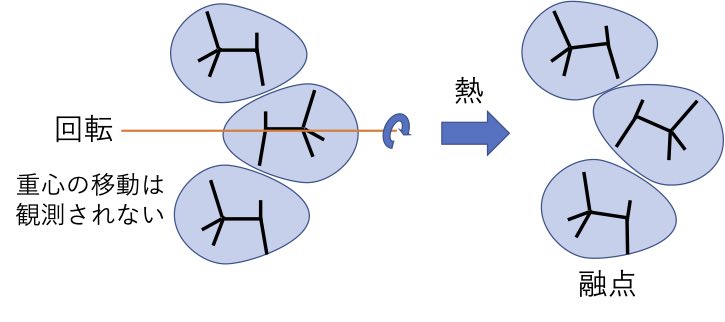
2,2,3-トリメチルブタンの結晶は温度が高くなっても、容易に回転できる結合がないので、分子の長軸方向に回転が始まります。しかし、重心の移動はないので融点とは観測されません。このような結晶を柔粘性結晶と呼びます。さらに温度が高くなって分子全体が動いて初めて重心が動き融点として観測されます。
極端な時には、重心の移動が起こる時には、液体にならず気化する場合があります。これを昇華と呼びます。
それに対して、自由回転を多く持つn-ヘプタンは、端の原子が少し動いただけで重心を移動させてしまいます。
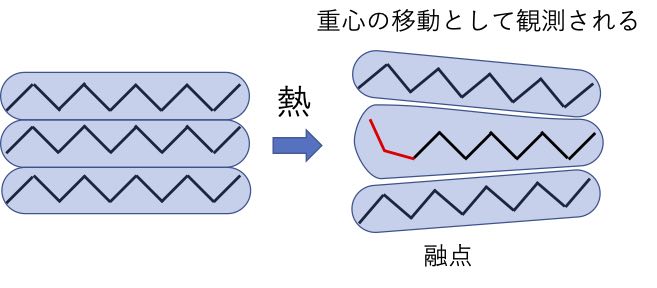
そこで低い温度で融点として観測されます。
また、エタン(C2H6)から少しずつ分子を大きくしていくと、融点は次の図のようにギザギザになります。
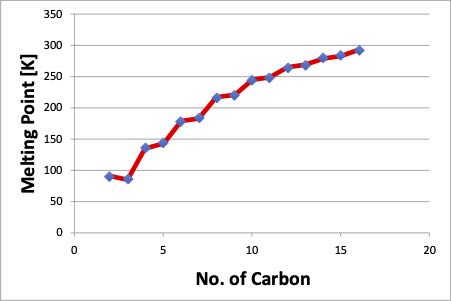
この偶奇性(化学結合の偶数と奇数で性質が変わる)は何故起こるのでしょうか?
これは、液晶や界面活性剤の設計で重要になります。しかし、これらが何故そうなるかに関しては「分子のパッキングなど複雑な原因が絡み合う」ので解き明かすのが難しい領域とされています。
しかし、化学結合のうち、擬結合の概念を取り入れると次のように説明されます。
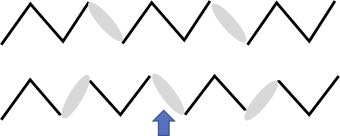
分子が結晶を作ったときに、炭素鎖が偶数の場合は、擬結合の向きが揃います。擬結合は通常の結合より少し長いと考えます。
炭素鎖が奇数のときは空間に同じ数の炭素を入れると、図のように偶数の時よりは擬結合の数は1つ増えます。そして擬結合の向きは交互に入れ替わります。この入れ替わりの為に炭素鎖が奇数の場合には融点が下がります。
化合物の密度に関しては、偶奇性は無いので、単純に擬結合が多くなると密度は下がると言えます。
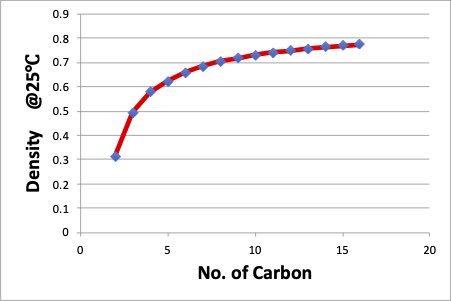
こうした分子のパッキングについては、薬とレセプターの鍵と鍵穴関係のように大事な問題ではありますが、結果を説明するのではなく、任意の組み合わせで予測できるほど計算機科学は進歩していないのが現状です。
このように、化合物の持つ化学結合と化合物の物性にはとても高い関係性があります。
特に、反応を伴うような解析には、分子軌道法(MO法:Molecular orbital)という計算機化学の方法を取ることが多いです。
ただ、燃焼現象は非常に複雑な反応経路を取るので、自然発火温度をMO計算から得るのは容易ではありません。
しかし、OHラジカルとの反応性などは、MO法で解析される事も多いです。
単純に言う化学結合、つまり、共有結合、イオン結合、金属結合、(水素結合)であっても、温度まで含めると、まだまだ分からないことだらけです。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
