

| ホームページ | Pirikaで化学 | ブログ | 業務リスト | お問い合わせ |
| Pirikaで化学トップ | 情報化学+教育 | HSP | 化学全般 |
| 情報化学+教育トップ | 情報化学 | MAGICIAN | MOOC | プログラミング |
2012.1.12
沸点の近いもの、共沸するものは蒸留では分離できません。

日本ゼオンのブタジエン合成法、GPB法は戦後の日本化学史上最高の技術開発と言われています。これは、DMFに対する溶解度の差を利用して、抽出蒸留によってブタジエンの見かけの沸点を変えて蒸留を行うものです。
DMFでの比揮発度のデータは見つかりませんでした。
その代わり、含水フルフラールを使った時の比揮発度のデータが入手できました。
溶媒が無い場合の比揮発度は沸点順になり、イソブテン、1−ブテン、1、3ブタジエンでほとんど差がなくなり蒸留できません。
抽出溶媒をうまく選べば比揮発度を大きくかえる事ができます。
比揮発度データ
C4留分をYMBを使って計算し、VSMRを使って比揮発度のモデル式を作製してみましょう。
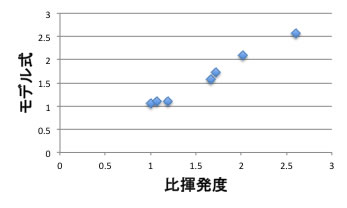
モデル式= -A*沸点 -B*Hansen dH +C
A-Cの係数を求めましょう。
何故、このようにハンセンの溶解度パラメータの水素結合項が非揮発度を変えるかというと、ブタジエンは2重結合を2つ持ち、下図のように、イソブテン、1−ブテンよりも大きなdHを持知ます。
そこで、抽出蒸留溶媒が大きなdHを持つと相互作用が大きくなってブタジエンだけ飛びにくくなります。
そこでDMF、NMP、フルフラールのようにdHの大きな溶媒が比揮発度を大きく変えることになります。
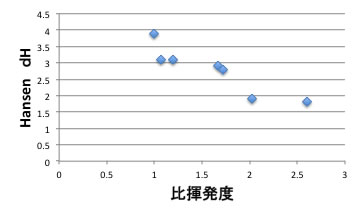
それは、一種ヘンリー定数にも似ています。
ヘンリーの法則(2011年講義資料参照、Pirikaのヘンリー定数のページを参照)とは、揮発性の溶質を含む希薄水溶液が気相と平衡にあるときには、気相内の溶質の分圧pは溶液中の濃度cに比例するというものです。
(一種の活量係数)その比例定数をヘンリー定数と呼ぶ。
(YMBが推算するのは水に対するヘンリー定数)
このヘンリー定数を比揮発度に対してプロットすると下図のように高い相関が認められる。
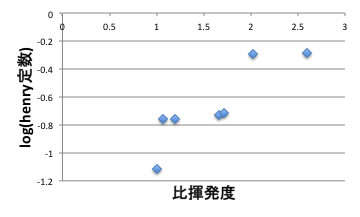
つまり、ブタジエンのヘンリー定数はイソブテン、1−ブテンの半分以下になります。
(ヘンリー定数が半分という事は同じ温度で、同じ濃度あった時に蒸気圧が半分になるということです)
フルフラールに対するヘンリー定数は水へのヘンリー定数と似ているのでしょう。
このように、沸点の似たものを蒸留で分けようとするなら、ターゲットと分けたいものの分子間力の構成の差を利用するのがもっとも有効です。
| 相互作用のタイプ | エネルギー | ハンセンの分類 |
ファンデルワールス相互作用: |
<1 KJ/mol |
分散項(δD) |
静電的相互作用: |
10-30KJ/mol | 分極項(δP) |
水素結合的な相互作用: |
10-30KJ/mol |
水素結合項(δH) |
その他: |
(δH) |
単純にはハンセンの溶解度パラメータの分散項(δD), 分極項(δP), 水素結合項(δH)の差から抽出溶媒を選定するのが早道です。
この考え方は抽出蒸留だけでなく、共沸蒸留に於いても有効です。
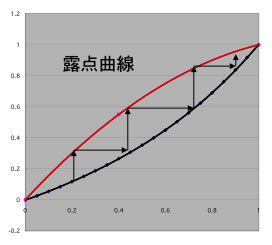
気液平衡がわかると蒸留の段数が計算できます。
P yi = γi xi Pis
P: 全圧,
yi: 気相のモル分率,
γi : 液相の活量係数,
xi: 液相のモル分率,
Pis: i成分の蒸気圧
このうち、活量係数というのが分かりにくいです。
単純には”純物質の蒸気圧が相互作用によってどれだけ変わるかの尺度”と覚えておいてください。
などの定数があります。
詳しいことは、こちらを参照してください。
その中で、ここでは、Magulesの活量係数式を取り上げてみましょう。
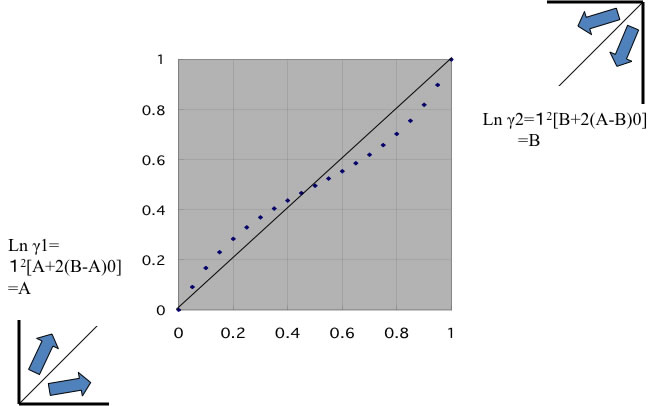
Ln γ1=x22[A+2(B-A)x1]
Ln γ2=x12[B+2(A-B)x2]
Wilsonパラメータと違い、両末端(無限希釈活量係数)付近でのみ精度があります。
物理的意味合いが高いので値を推算することが可能になります。
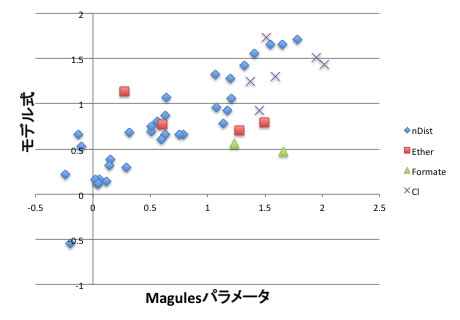
モデル式= A*ハンセンdD -B*ハンセンdP -C*ハンセンdH -D
VSMRを用いてA~Dの係数を定めて見ましょう。
一部の溶媒で乖離が大きいですが、上記モデル式でエタノールに対するMagules Bの値を推算する事ができます。
この式にエタノールの値を入れれば、-0.124になるのでほぼ0になります。
つまりエタノールとなら活量係数は1になります。
それを模式図的に表せば、下のようになります。
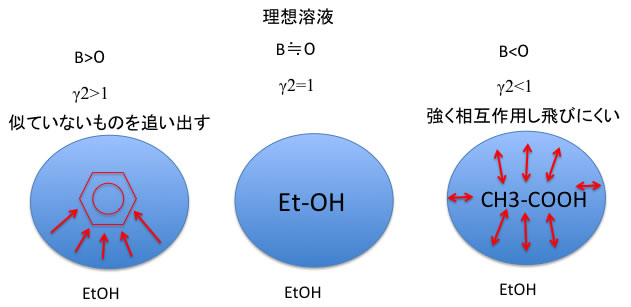
こうした活量係数を求める一般式にまで拡張すれば、ASOG法やUNIFAC法になります。
(ASOG法を用いた気液平衡の推算はこちらから。 分子構造のみから気液平衡を計算できます)
注目したいのは、この活量係数であっても分子間力、つまりハンセンの溶解度パラメータで表されるという事です。
”似たものは似たものを溶かす”という単純な原理に深い原理が潜んでいるようです。
このハンセンの溶解度パラメータ法を使った気液平衡の推算のプログラムを、2013年講義用に準備しました。
また、そうしたプログラムをどのように作成するのか解説しました。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください) メールの件名は[pirika]で始めてください。