2009.9.9
pirika.comで化学 > 化学全般
> 次世代HSP2, YMB Pro for MI >
> 解析例トップ
ポリマー・トップページ
概要
ある高分子があったときに、それを溶解する溶媒を探索したいという要望は多いだろう。
ハンセンのSP値を使った、溶媒、混合溶媒の探索方法を紹介する。
ポリマー同士の溶解性や相溶化剤の設計にも溶解度パラメータの考え方は重要だ。
一つ一つは貧溶媒でも、混合溶媒になると良溶媒になる場合がある。
この現象を理解しようとするなら、HSPを使わなくてはダメだろう。
内容
詳しい内容は
化学工業社、化学工業2010年4月号をご覧頂きたい。 (化学工業社はなくなってしまったのでpdfをおきます)
Sphere(球)というのは、ある溶質を溶解する溶媒は、ハンセンの溶解度パラメータが似ていて、それを3次元空間(ハンセン空間)にプロットすると似た位置に配置され、球を構成するという、ハンセン先生が考えた理論だ。

その際(1967年)には上のような装置を組み、溶媒のHSP(ハンセンの溶解度パラメータ)の位置に溶媒名を書いたタグを付けて、溶解したものとしなかったものを色分けして、検討したそうだ。
同じことをコンピュータの上でやると次のようになる。
基本的な溶媒については、1967年の段階でHSPは決定されていた。
この溶媒を3次元空間にプロットしてみよう。
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
小さな球をマウスでクリックすると、溶媒の情報が表示される。
この溶媒がポリスチレンを溶解したら、球の色を赤にしてみる。溶解という定義は人それぞれだ。ポリマーの膨潤、粘度、機械強度の劣化でもなんでも良い。HSPが既知の溶媒の間で差が出れば良い。
一部赤い球と青い球が重なる領域がある。そのような例外もあるが、なるべく赤い球だけが大きな球の内側にくる球を考えてみる。
これは現在ではHSPiPというソフトウエアーを使って探索する。
Isobutyl Phthalateだけが緑の大きな球の内側に入り込んでしまった。
フタル酸エステルは、ポリマーの可塑剤に使われる化合物だ。本来ポリマーによく溶けているべきものだ。しかし、分子のサイズが大きいので、可塑剤として働く時には、ポリマーの中に閉じ込められ外に出てこない。逆に溶媒に使った時には、HSP的には溶解するはずだが、ポリマーのネットワークの中に入り込めない溶媒になる。

この緑色の大きな球がハンセンの溶解球になる。試験していない溶媒でもそのHSPの3次元座標が、この溶解球の内側にくれば、溶質を溶解すると判断できる。
溶解球の半径を相互作用半径と呼ぶ。
溶解球の中心(小さな緑の球)の座標が溶質のHSPになる。
基本的には、やることはこの繰り返しだ。
ポリマーの溶媒探索
ハンセンの溶解度パラメータ(HSP)を用いた高分子の溶媒を探索する方法を簡単に紹介しよう。
V-tubeでの説明はこちらを参照:ポリスチレンの溶解性をHSPiPで解析
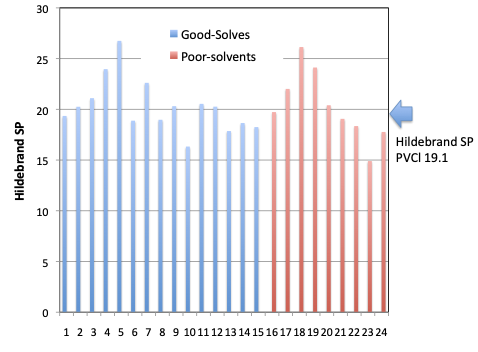
通常のSP値(ヒルデブランの溶解度パラメーター)を用いて溶媒探索をした場合にはその的中率は50%ちょっととされている。
どうしてそのように低い値になるのかはHSPを使う10の理由で詳しく述べているが、HildebrandのSP値は蒸発潜熱が近く、分子体積が近ければ同じような値になってしまう。HildebrandのSP値 (tot HSP)が15.0になる化合物は71化合物ある。
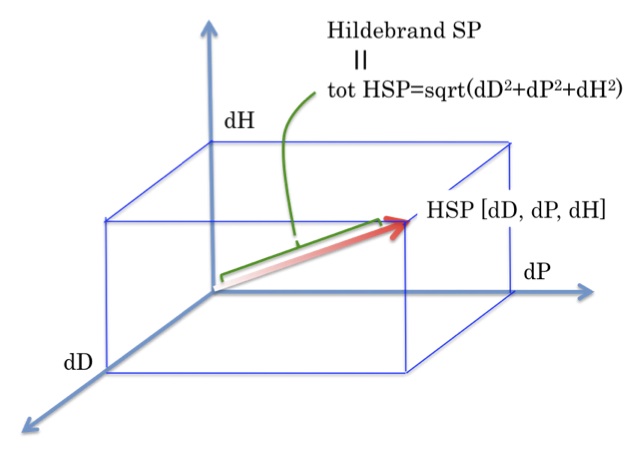
それに対してHansen Solubility Parameter(HSP)はSP値を分散(dD)、極性(dP)、水素結合(dH)の3つに分解し、3次元のベクトルとして捉える。上の3D図で、HildebrandのSP値 (tot HSP)は同じだが、ベクトルの方向は異なる。
そして、そのベクトルが似たものがお互いを溶かすという理論で、的中率は非常に向上する。
さらにHansenの方法は相互作用半径(R0)というものを導入して、さらに的中率を向上させる仕組みを持っている。
これはポリマーを扱った事のある人なら感覚的によくわかる事だと思うが、ポリマーには色々な溶媒に溶解しやすいポリマーと、フッ素系高分子のように溶ける溶媒がほとんどないポリマーがある。
つまり、溶媒のベクトルがポリマーのベクトルと多少離れていても溶かしたり、ほとんど一致していても膨潤ぐらいしかしないもの、その中間に分かれる。そこで、ある溶媒のHSPベクトルが、その半径に入れば溶解する、半径の外なら溶解しない、そうした最大の半径、相互作用半径(R0)をポリマーごとに定める。
具体的には、溶解性を検討するのに必要なパラメーターは次のように定める。HSPが既知の溶媒を使って、ポリマーの溶解性試験を行い、溶解した溶媒の組と溶解しない溶媒の組を決める。溶解しない場合には膨潤性の大小でも、分散性の大小でもよい。そして、溶解した溶媒のHSPベクトルがすべて球の内側に来るような、また溶解しない溶媒のHSPベクトルはすべて球の外側に来るような、最小の溶解球を定める。(場合によると、いくつかの溶媒は例外となることもある。)
そして、この球の半径を相互作用半径(R0)と呼び、球の中心点をそのポリマーのHSPベクトルと定める。これらのパラメータが求まれば、任意の溶媒に対して、ポリマーとのHSP距離を計算し、それが相互作用半径よりも小さければ溶解する、大きければ溶解しない確率が非常に高いと判断する事ができる。
そこで、溶媒とポリマーのHSP距離を計算し、それが相互作用半径よりも小さければ溶解する確率が非常に高くなる。
例えばポリスチレンのHSPは[18.5,4.5,2.9]で相互作用半径は8である。この球の内側に来る溶媒としては,クロロベンゼン[19.0.4.3.2.0]HSP距離=1.36,トリクロロエチレン[18.0,3.0,5.3] HSP距離=3.00,トルエン[18.0,1.4,2.0] HSP距離=3.34である。こうした情報があると,例えば,インスタント食品の容器で問題になった,防虫剤成分のポリスチレン容器に対する移り香は次のように説明される。防虫剤の成分、パラジクロロベンゼンのHSPは[19.7,5.6,2.7]なのでポリスチレンからのHSP距離は2.65になる。すなわち,パラジクロロベンゼンはポリスチレンに非常に溶解しやすい事がわかる。このようにHSPを使うとHSP距離の大小で溶解性を判断できるので非常に簡便である。
中略
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
PMMAを溶かす溶媒(赤い小さな球)と溶かさない溶媒(青い小さな球)をハンセン空間にプロットしたものだ。
幾つかの例外もあるが、赤い溶媒は3次元的に似たような位置を占めていて、それらを取り囲むSphere(ハンセンの溶解球:緑色の大きな球)があると理解できる。
そこでPMMAを溶解する溶媒を探索したいのであれば、溶媒のHSPがこの緑の球の内側に来るようなものを選べばいいことがわかる。
中略
次に、各溶媒のハンセンの溶解度パラメータを入手する。
HSPiPというオフィシャルのソフトウエアーを購入すれば最新のHSPのデータベースも含まれているし、データベースに記載の無い化合物については推算値を得ることができる。
そしてHSPの値が得られたら、次の表のようにまとめる。
ここでScoreは1が溶解するもの、0が溶解しないものだ。この表の化合物の名称から先をタブ区切りのテキストファイルでセーブ(拡張子をssdにする)すれば、それをHSPiPで読む込む事ができます。
その後はソフトウエアーがポリ塩化ビニルのHSPは[18.8, 9.2, 6.3]で相互作用半径は7.3であるとたちどころに計算してくれる。
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
中略
2011.4.22
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
こうしたSphereが2つあると仮定して探索する新しいアルゴリズムも付け加えられた。
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
また、溶媒は混合溶媒でも同じように取り扱われます。ひとつひとつが貧溶媒でも上の例のように、HSPの混合ベクトルが球の内側に来ればその溶媒に溶解する。
2.2. 実際の溶解性検討
Polymer Handbook6)に記載されている例を使って実際に計算する。Polymer HandbookにSolvent and Non Solvents for Polymers というページがあり、様々なポリマーの良溶媒、貧溶媒が一覧表になっている。そこからポリ塩化ビニルの良溶媒、貧溶媒を抜き出してみる。次に、各溶媒のHSPを入手する。ポリマーハンドブックやインターネットで検索しても見つかるが、値が古かったりするのであまり勧められない。HSPiPというオフィシャルのソフトウエアーを購入すれば、最新のHSPのデータベースも含まれるし、データベースに記載の無い化合物については推算値を得ることができる。そしてHSPの値が得られたら、Table 1のようにまとめる。ここでScoreは1が溶解するもの、0が溶解しないものである。この表をタブ区切りのテキストファイルでセーブ(拡張子をssdにする)すれば、それをHSPiPで読む込む事ができる。その後はソフトウエアーがポリ塩化ビニルのHSPは[18.8, 9.2, 6.3]で相互作用半径は7.3であるとすぐに計算する。
各溶剤のHSP値とポリ塩化ビニルの溶解性
ここではHSPiPをまだ持っていないと仮定して、簡略的にポリマーのHSPを求めてみる。つまり、溶解する溶媒のHSPの平均値をポリマーのHSPと考えてみる。
平均値は[17.7, 7.9, 5.5]になる。
次に,ポリ塩化ビニルのHSPが [17.7, 7.9, 5.5]だとした場合に、各溶媒からのHSP距離を求める。
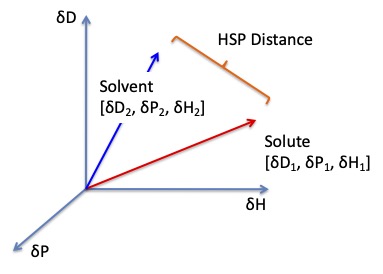
ベクトルの距離なので差の2乗和のルートを取れば良いのだが、HSP距離と言った時にはdDの前に4.0という係数がつく。
HSP distance(Ra)={4*(dD1-dD2)2 + (dP1-dP2)2 +(dH1-dH2)2 }0.5
それをプロットして見るといくつかの例外はあるが,HSP距離が8近辺の領域では溶けるか溶けないかが微妙になる。
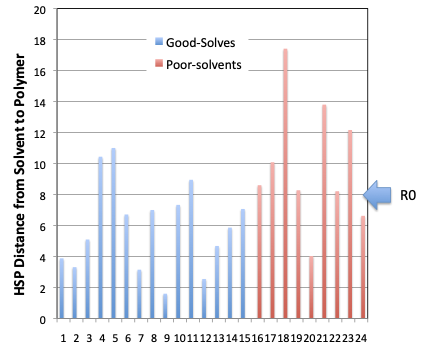
それ以下だと溶解する。それ以上だと溶解しない。そう考えた時に的中率は約80%になる。ポリマーの分子量,分子量分布の効果,開始剤,添加剤の効果など様々な要因で例外が出てくる。
外れるものは,DMF,DMSO,Dioxane, Toluene, Vinyl Chlorideの5つだ。
HSP距離が短いのに溶けない理由としては,例えば分子のサイズが大きくポリマーの中まで浸透しない,溶解する方向ではあるが溶解するのに非常に長い時間を要する,特に室温でガス上の化合物など,液密度が低いなどが考えられる。
逆にHSP距離が長いのに溶解する溶媒は解釈が難しい。エントロピー効果が大事とも言われている。
DMFやDMSOは様々な系で例外になりやすい。これらは大きな極性項(dP),水素結合項(dH)を持つ。そこでHSP距離を計算すると疎水的なポリマー(dP,dHの値が小さい)からは大きな値になってしまう。しかし実際は水、カルボン酸、低分子のアルコールなどと同様に水素結合によってクラスターを作っている。そのようなクラスターを作った場合には、見かけ上,大きな水素結合項はキャンセルされ、疎水的な化合物も溶解する事ができる。
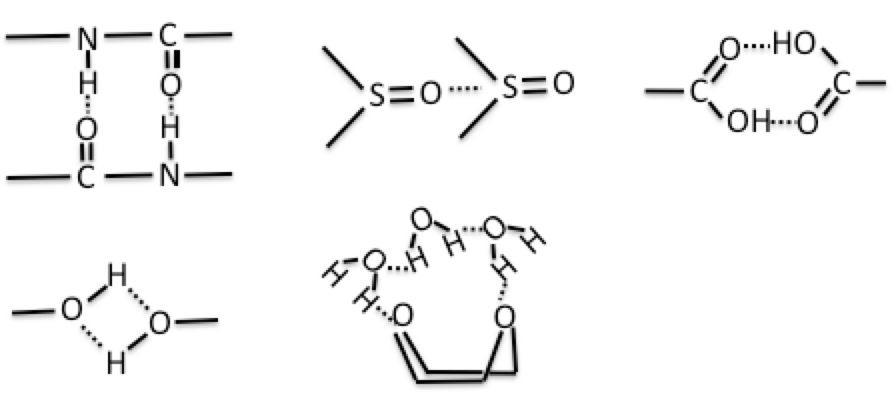
ジオキサンも本来は親水性のあまり大きくないエーテル化合物であるが、構造的に水と水素結合しやすく100%水に溶解する。そこで親水性、疎水性の両面を持つ化合物の溶解度は単純にHSP距離だけでは理解できないが、一般的な溶媒に対しては非常に良好に溶解性を評価する事が可能である。一旦ポリマーのHSPが決まれば,後はHSP距離が8以下の溶媒を探索すれば、高確率で良溶媒になる。
それに対してポリマーの溶解度をHildebrandの溶解度で見てみる。ポリ塩化ビニルのSP値の文献値は19.1である。確かにその付近の溶媒で溶解するものは9種類と多いが,それ以下でも、以上でも溶かすものが多くある。また溶かすものと溶かさないものの分布がほぼ同じで,これでは、ある溶媒がポリ塩化ビニルを溶かすか溶かさないかは何も言えない。
もう一つ,HSPを使ってポリマーの溶解度を考える事のメリットを紹介する。先ほどのポリ塩化ビニルの良溶媒として,Acetone/Carbon Disulfide混合溶媒が記載されている。この二つの溶媒はどちらも貧溶媒にリストアップされている。貧溶媒の混合物が良溶媒になる例は非常に多く知られている。HSPでは溶媒の混合物はベクトルの足し算を使う。つまりAcetone[15.5, 10.4, 7] ,Carbon Disulfide[20.2, 5.8, 0.6] の50:50混合物のHSPは[(15.5+20.2)/2, (10.4+5.8)/2, (7+0.6)/2] = [17.85, 8.1, 3.8]になる。これと簡易的に求めた、ポリ塩化ビニルのHSP [17.7, 7.9, 5.5]とのHSP距離は1.74となり,非常に良く溶解すると予測され、事実良溶媒であった。このように簡便に混合溶媒を扱える溶解度理論はHSPだけである。下図で確認してみよう。アセトンとCarbon Disulfideは線で結んである。
中略
例えばポリマー中に数%水酸基が入っただけで(ポリマー全体としてのHSPはあまり変わらないのだが)溶解度が大きく変わる事はよくある。
またHSPの現バージョンでは未考慮ですが,ドナーーアクセプターの考え方(こちらの記事を参照)が必要な場合,ポリマーの分子量,分子量分布の効果,開始剤,添加剤の効果など様々な要因でいくつかの例外が出てくる。
中略
HSPiPには”Solvent Optimizer”が搭載されており,こうした(混合)溶媒の探索がたちどころにできる。
こうした混合溶媒を取り扱える溶解度理論はHSPだけではないだろうか。
ポリマーのIPNを設計したい場合などは、ポリマー同士の球がどのくらい重なり合っているかを調べる必要がある。
ポリマーの相互作用半径が重なるものはポリマー同士も相互溶解しやすい。
相溶化剤を設計したいなら片方の球に溶解する部分ともうひとつの球に溶解する部分とをひとつの分子に持たせる必要がある。
エポキシ系やウレタン系の接着剤などを検討する場合には注意が必要である。
エポキシ基やウレタン基はどちらかというと極性が高く、それ以外の部分は極性の低いポリオールであることが多い。
そのようなミクロ相分離構造をとるポリマーの場合、オーバーオールのHSPを考えても溶解性は理解出来ないことがある。
V.3.1.x以降に搭載のDouble Spheresの機能を使うと、両方の部分構造に相当する球が見つかる。相溶化剤やオリゴマーなどにも適用することをおすすめする。
2010.12.2 追記
化学工業の連載第2回でポリマーの溶媒探索に関してPMMAの解析の失敗例を説明した。
これは溶媒の多様性が足りなく、限られた溶媒だけでHSPを決めると正しい答えにならないよ、というものだ。今回、データを継ぎ足して、新しくPMMAのHSPを決め直してみた。
求まったHSPは[17.7, 6.7, 6.2]で相互作用半径は8.96になった。
使った溶媒は57種類。溶解しないとされる溶媒で、緑色の球の中に入ってしまった例外が4点あるが、53/57=93%の確率で溶解する、しないを判定できるという結果になった。
Ver.3.1.xのDouble Spheresの機能を使うと、
[16.7, 9.7, 8.4] 半径7.24 の球と
[18.4, 3.2, 2.9] 半径4.22の球があり、例外となる溶媒は2つある事が解る。
これは、これできれいな結果ではあるが、今回強調したいのは、ポリマーハンドブックによるとPMMAはエタノール/水の混合溶媒に溶解するという記載がある点だ。
PMMAは透明性の高い樹脂で、水族館の水槽などにも使われている。これがエタノール/水の混合溶媒に溶けるという現象をHSPを使ってさらに解析してみる。
| water | EtOH | dDm | dPm | dHm | Ra | HildebrandSP |
| 100.0 | 0.0 | 18.1 | 17.1 | 16.9 | 14.939 | 30.1 |
| 90.0 | 10.0 | 17.9 | 16.3 | 17.2 | 14.543 | 29.7 |
| 80.0 | 20.0 | 17.6 | 15.4 | 17.4 | 14.202 | 29.4 |
| 70.0 | 30.0 | 17.4 | 14.6 | 17.7 | 13.925 | 29.0 |
| 60.0 | 40.0 | 17.2 | 13.8 | 17.9 | 13.710 | 28.7 |
| 50.0 | 50.0 | 17.0 | 13.0 | 18.2 | 13.565 | 28.3 |
| 40.0 | 60.0 | 16.7 | 12.1 | 18.4 | 13.489 | 28.0 |
| 30.0 | 70.0 | 16.5 | 11.3 | 18.7 | 13.484 | 27.6 |
| 20.0 | 80.0 | 16.3 | 10.5 | 18.9 | 13.550 | 27.2 |
| 10.0 | 90.0 | 16.0 | 9.6 | 19.2 | 13.687 | 26.9 |
| 0.0 | 100.0 | 15.8 | 8.8 | 19.4 | 13.891 | 26.5 |
| dD | dP | dH | Hildebrand | |||
| EtOH | 15.8 | 8.8 | 19.4 | 26.5 | ||
| Water | 18.1 | 17.1 | 16.9 | 30.1 | ||
| PMMA | 17.7 | 6.7 | 6.2 |
水とエタノールの混合比率を変えながら、混合溶媒のHSP、[dDm, dPm, dHm]を上の表のように準備する。
そして、今回求めたPMMAのHSPを用いて溶媒からの距離(Ra)を計算する。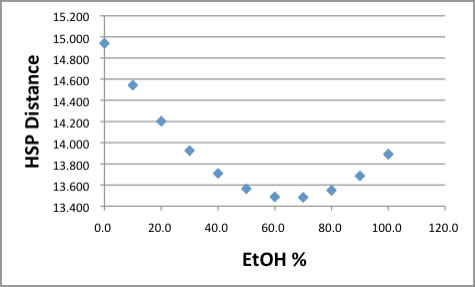
グラフに示すように、HSP距離はEtOHの分率が70%位の所で最小になる。
それでもHSP距離は13以上で、相互作用半径(8.96)よりも長いので常温では溶解しないと考えられる。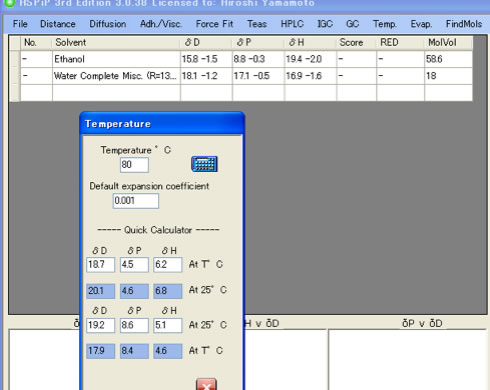
温度を変えたHSPで検討すると、エタノールの比率は50%で最小になり、HSP距離はさらに短くなる。温度の効果についてはさらに検証が必要と思われる。
また、アルコール/水は混合した時に発熱する。そのような系では当然、混合HSPは単純な足し算では合わない。
そうした検証が必要ではあるが、通常では思いもしない混合溶媒でダメージを受けてしまう現象に対してHSPは有効である。
ニトリル・ブタジエン・ゴム(NBR)がガソリンとエタノールで膨潤してしまうことも同様に理解できる。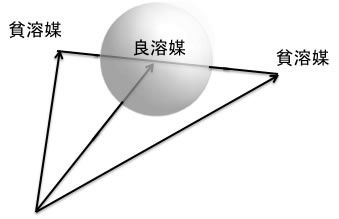
当たり前の事ではあるが、HildebrandのSP値では何も解らない。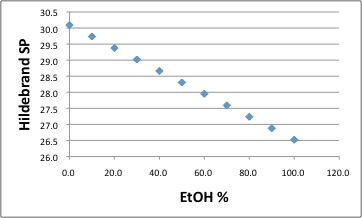
2012.5.7
ユーザーからの質問で多いのが、溶ける溶媒が殆ど無い場合どうやってポリマーのHSPを求めるか?というものだ。
例えばフッ素ポリマーのHSPはフィルムを作り、溶媒に1週間浸漬しテンシロンを測定し、引張強度の低下率でScoreを決めHSPを決定したというような例がある。
エポキシ樹脂など(こちらの記事を参照)では、膨潤度などから求める。
ポリマーを細かく粉砕してガスクロのカラムに詰めてインバース・ガスクロを測定(Acta Chromatographica 20(2008)1, 1–14)している例もある
。
エンジニアリング・プラスティックの耐ストレスクラッキングを測定した例から求めるのもひとつの方法だ。
ポリマー同士の混合がどうなのかはこんな調べ方をする。
HSP距離も大事だが、ポリマー同士のSphereどのくらい重なっているかも大事になる。
(計算する機能はHSPiPにも搭載されている)このプログラムはHTMLの手習で作ったが公開はしていない
塗料などの顔料分散について検討したいなら、こちらの資料が役に立つ。
ドナー/アクセプターを含めた顔料分散
2012.5.31
ある海外のユーザーからポリマーをYMBを使って計算するときに困ったことが起きると相談を受けた。
彼らの直接のターゲットは明かせないが、ポリビニルアルコールで説明しよう。
下のようなポリマーのHSPをYMBを使って計算しようとすると困ったことになる。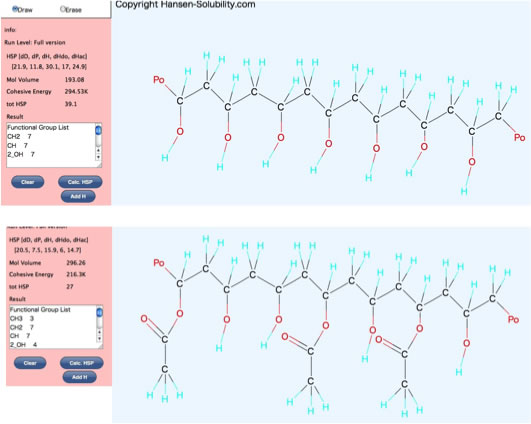
まず、ポリビニルアルコールの1-10量体のSmilesを準備する。
(ポリマーSmilesはこちらを参照)
それをYMBで計算すると、dH項がどんどん大きくなってしまう。
それはアルコールの数がどんどん多くなって砂糖のようになるので、YMB的には正しい。
ところがポリマーとしてみた場合に、重合度nのときとn+1でHSPは変わってほしくない。
さもないと上のようにOHを修飾した場合、修飾基の効果(数、種類)なのか、OHが減った効果なのかわからなくなってしまうからだ。
これは原子団の加算値と体積の加算値がずれている事に起因する。(何度も言うが低分子を扱うYMB的には正しい)
2012.6.15
ポリマーSmilesにXが複数あってもいいのかという問い合わせを頂いた。
計算値自体は問題ないが、多量体(X-mer)を作る際には問題になる。官能基がXをまたがないように作るのがポイントだ。
pirika.comで化学 > 化学全般
> 次世代HSP2, YMB Pro for MI >
> 解析例トップ
ポリマー・トップページ
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください
