2020.11.30改訂
その他の化学トップページ >
(1992年ごろC言語で作成。2012年ごろJavaScriptプログラム化)
CNDO/2というのは、Complete Neglect of Differential Overlap法のver.2という分子軌道を計算するソフトウエアーです。
電子反発積分に含まれる微分重なりを無視して計算する、半経験的分子軌道計算方法です。
オリジナルのプログラムは、菊池先生の書籍のFORTRANのプログラムです。
この本に載っているのは、H-Fまでの原子だったので、CINMINというQCPEのソフトからパラメータを移植して、H-Clまで計算できるようにしています。

分子軌道のいい加減な説明
まず、最初に簡単に分子軌道法について説明しましょう。
原子の周りには電子が回っています。
太陽の周りに惑星が回っているのをイメージしてください。
一番内側に水星、次に金星、地球、火星とだんだん距離が離れたところを回っています。
原子も同じで、原子核の近いところを回っている電子と、離れた所を回っている電子がいます。
惑星との違いは、惑星はほぼ円を描いて(平面を)回っていますが、電子は球の表面を(立体的に)回っています。
近いところを回っている電子は球の表面を回っていますが、外側になるに連れ、彗星のように偏った軌道を取るものも現れます。
そうした軌道のうち、球の軌道をとるものをS軌道、その上はP軌道、d軌道、f軌道とどんどん複雑なまわり方をします。
ある瞬間にある確率でそこに存在するという言い方しかできないので、まるで雲のように存在する、電子雲と呼ばれます。
各軌道には電子が2個まで入ります。原子が組み合わさって分子になると、この原子軌道が混じり合って分子軌道を作ります。
それでも基本的考え方は同じで、分子軌道の一番エネルギーの低い軌道からから順番に電子が2個はいります。
元素の周期律表はその電子の入り方で整理されています。
そして原子が持っている電子の総和分だけ低い方から軌道が埋まっていき、一番高いエネルギーの軌道をHOMOと呼びます。
その上には電子が入っていない軌道があります。そのうち一番低いエネルギーの軌道をLUMOと呼びます。
電子が紫外光などのエネルギーを受けて励起すると、HOMOからLUMOへ飛び移り、光や熱を放出してまたHOMOの軌道に戻ります。
原子と原子がくっついて分子を作るときには、こうした電子が接着剤のように原子と原子の間にいる確率が高くなります。
それを結合と呼んでいます。
その結合の種類にはシグマ(σ)結合とパイ(π)結合があります。
我ながら、いい加減な説明ですね。。。
それでは実際に分子軌道を見ていきましょう。
まず、エチレンの分子軌道です。
ここに表示されているCNDO/2の結果は、サーバーに置いてある計算結果を表示しているのではありません。
サーバーからは、CNDO/2のプログラムとエチレンの構造が送られてきて、今表示されているデバイスのブラウザーの上で計算された物を表示しているのです。
非力なデバイスを使っていると計算が遅いかもしれません。
分子を回転:マウスでドラッグ(マウスボタンを押したまま動かす) iPadでは指一つで押さえて動かす
位置を動かす:Alt(MacではOption)キーを押しながらドラッグ。 iPadでは指3本で動かす
拡大・縮小:Shiftキーを押しながらドラッグ。iPadでは指二本で横に広げる、狭める。
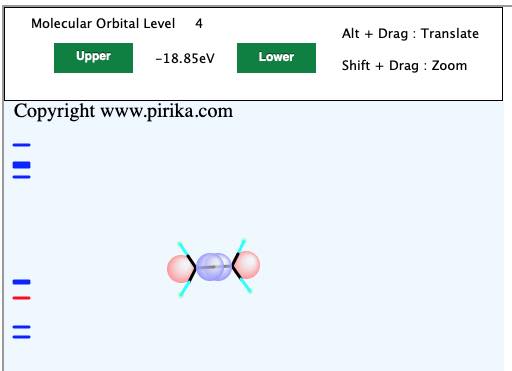
左側のところに青色のバーコード見たいなものが表示されています。これは分子軌道のエネルギーレベルを表しています。
赤い線は今表示されている分子軌道のエネルギーレベルです。最初に計算したての時には、HOMOになるようにしてあります。
HOMOというのは、Highest Occupied Molecular Orbitalで最高被占軌道、つまり電子が入っている軌道のうち一番エネルギーレベルが高い軌道のことです。
エチレン分子のHOMOのエネルギーは-15.6eVであることが判ります。
eVというのはエレクトロン・ボルトと読みます。これはエネルギーの単位の一つで、電子1個の電荷が1ボルトの電位差で加速される時に得るエネルギーのことです。
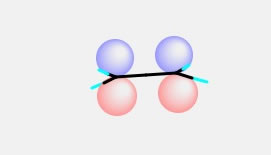
エチレン分子は平面構造ですが、その平面に垂直方向へ4つの球が見えるでしょう。これがエチレンのP軌道を表しています。最近のちゃんとしたソフトウエアーはContourという等高線図で軌道を表すのが主流ですが、自分は昔ながらのChrmDrawなどで利用したこうした表示の方が好きです。(プログラムが容易であるというのもありますが)
このHOMOの分子軌道で大事なのが、赤丸と青丸が同じ向きに揃っていることです。
これを位相が揃っているという言い方をします。位相が揃っている軌道は結合性軌道で、2重結合のπ結合を作ります。
実はP軌道は方向性を持っているので、Px, Py, Pzの値を持っているのですが、この簡略化した表示システムでは、この方向をベクトルとして捉えて、そのベクトルの方向に球を描くという方法を取っています。(その方が分子を回転させたときに表示が便利なのです。)
それでは、次にLUMOを見てみましょう。
LUMOというのはLowest Unoccupied Molecular Orbitalで最低空軌道、つまりエネルギーの一番低い、電子の入っていない分子軌道のことです。
CNDO/2の結果表示のところで、Upperボタンを押してみてください。
LUMOのエネルギー準位は4.92eVです。
HOMOの-13.77eVからは大きなギャップがある事がわかるでしょう。
そして特徴的なのが、赤丸と青丸が入れ替わっている事です。この状態を、節があると言います。位相が揃っていないので、反結合性の軌道になっている事がわかります。
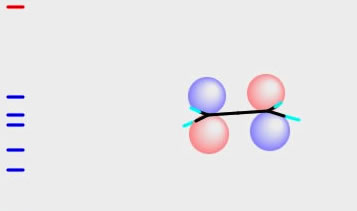
強い光のエネルギーを与えると、HOMOの電子はLUMOに励起します。こうした事から、HOMOとLUMOは特に重要な分子軌道という事ができます。
電子が詰まった軌道の外れ(HOMO)と電子のいない軌道の外れ(LUMO)という事で、辺境を意味するフロンティア分子軌道と呼ばれています。
これは、1952年に福井謙一先生によって提唱され、1981年にノーベル化学賞に輝いた理論です。
さらに下の方の軌道を見ていくと、結合軸方向に位相が重なるP軌道があります。こうした結合はσ結合と呼びます。
こんな分子軌道が表示されるはずです。
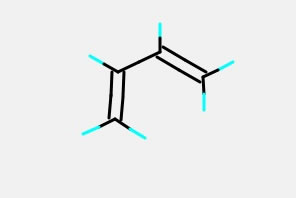
次にブタジエンの構造を作ってみましょう。
これは、Part Moveを使って、真ん中の結合を回すと簡単に作れます。
そしてCNDO/2計算を行うと、下のようなHOMOが得られます。
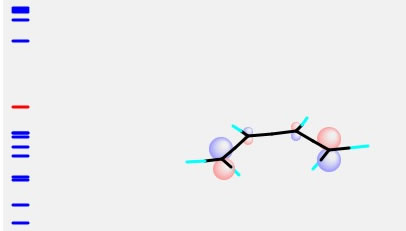

これはエチレンのLUMOと色が合わせられることが判るでしょう。
ブタジエンのLUMOは次のようになります。
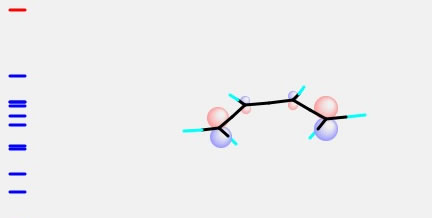

これは、エチレンのHOMOと色が合わせることができます。
ブタジエンのような共役ジエンとエチレンのようなアルケンが付加反応を起こして6員環構造を作る反応を、Diels-Alder(ディールス・アルダー)反応と呼びます。これは1950年にノーベル化学賞を得た反応です。
この反応も、フロンティア電子理論やウッドワード・ホフマン則(1965年発表、福井先生と1981年ノーベル化学賞)で説明できる事がCNDO/2の計算結果からわかるでしょう。
ちなみにエチレンのHOMOとエチレンのLUMOは色が合いません。だから4員環は生成しません。
次にアセチレン分子を作って計算すると、次のようになります。
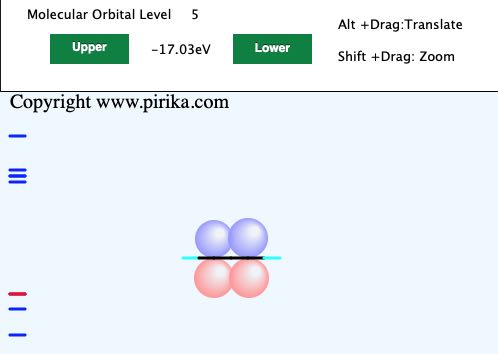
エチレンと同じように見えますが、Lowerボタンを押してみてください。
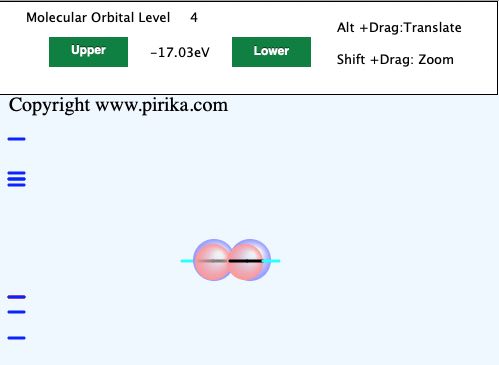
エネルギーレベルが全く同じで、パイ結合が画面に垂直に出来ていることが判ります。これを軌道の縮退と呼びます。つまり、画面の上下方向のパイ結合と垂直方向のパイ結合は等価となります。この2つのパイ結合で3重結合を作っているという事です。
このアセチレンのπ結合を1つ使って重合すると、もう一つのπ結合が順番に残った、ポリアセチレンという高分子ができます。
そうした重合反応に分子軌道計算がどのように役に立っているかは、pirikaの高分子のページを参照してください。
それでは、実際に2重結合を伸ばしていきましょう。そして、ひとつ伸ばすたびに構造を取り出し、CNDO/2で計算し、その時のHOMOとLUMOのエネルギーレベルを書き留めていきましょう。
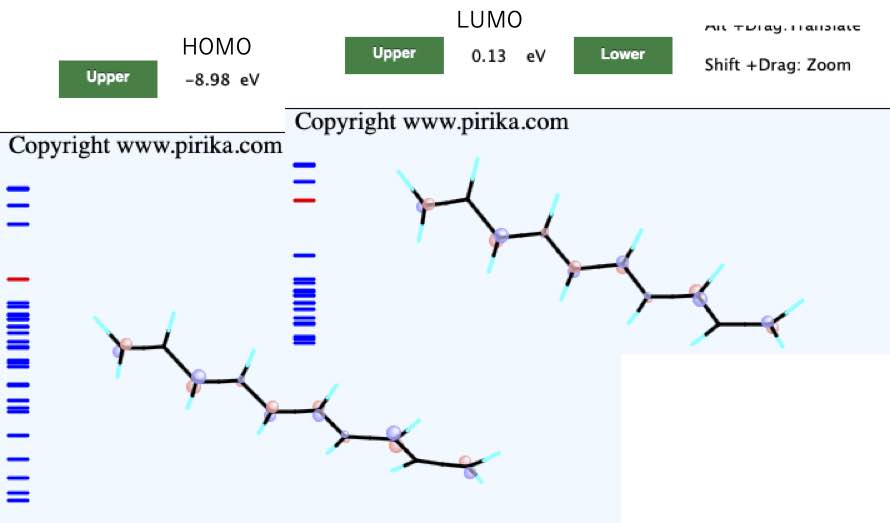
そのHOMOやLUMOの値と2重結合の数をプロットすると次のようなグラフになります。
つまり2重結合が増えるに連れ、HOMOのエネルギー準位は高くなり、LUMOのエネルギー準位は低くなります。
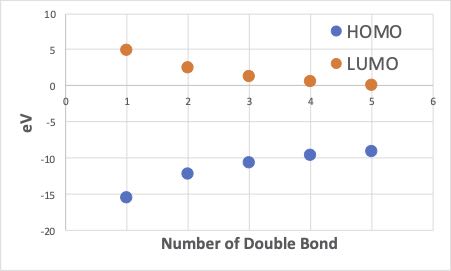
この事は、2重結合の数がとても多い、高分子(ポリアセチレン )になるとHOMOからLUMOに電子が飛び上がるのにエネルギーがほとんど必要ない状況になる事を予想させます。
金属に電気が流れるのは、電子が軌道に縛りつけられなくなった自由電子を持つ場合です。
そして、電気の流れる、金属のような光沢を持ったポリアセチレンを作った白川英樹先生は2000年にノーベル賞を受賞されました。
分子軌道法自体は
ロバート・マリケン、1966年 分子軌道法による化学結合および分子の電子構造に関する研究
ウオルター・コーン、1998年 密度汎関数法の開発
ジョン・ポープル、1998年 量子化学における計算化学的方法の開発
でノーベル化学賞を取っています。
20年前のスーパーコンピュータの性能より、現在のスマホやタブレットは余程性能は上になっています。
まずは、こうした簡便なソフトで使い方を理解して、その後は本格的な分子軌道のソフトをインストールしていきましょう。様々なフリーウエアーや、アカデミックは無料のソフトがあります。
その他の化学トップページ>
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
